

| 5 |
| 6 |
| 250 |
| 25 |
| 3.32 |
| 3.34 |


科目:高中化学 来源: 题型:
| A、1mol Cu和足量稀硝酸反应产生NA个NO分子 | ||
B、在18g
| ||
| C、1 molCl2参加反应转移电子数一定为2NA | ||
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则:
为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则:查看答案和解析>>
科目:高中化学 来源: 题型:
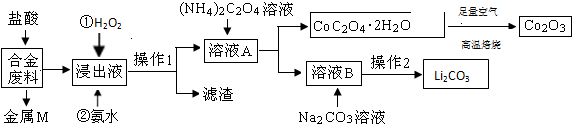
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
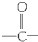 )的化合物
)的化合物 (R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯
(R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯 反应生成有机酸酯,例如
反应生成有机酸酯,例如

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用AgNO3溶液可鉴别HCl溶液和NaCl溶液 | ||||
B、用BaCl2溶液鉴别SO
| ||||
| C、用浓HNO3与Cu反应制备NO2 | ||||
| D、将混合HCl的Cl2通入饱和NaHCO3溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com