
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变,仅将容器的体积缩小一半,反应速率减小
B. 其他条件不变,适当增加C(s)的质量会使反应速率增大
C. 保持压强不变,充入少量氦气,反应速率会减小
D. 若v(CO)=v(H2O) ,则反应达平衡状态
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应HCO3-+Ca2++OH-=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热OH-+NH4+ ![]() H2O+NH3↑
H2O+NH3↑
C.氢氧化镁与稀硫酸反应H++OH-=H2O
D.单质铜与稀硝酸反应Cu+2H++2NO3-=Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 还原性:Al>Mg>Na B. 原子半径:Cl>S>O
C. 稳定性:HBr>HCl>HF D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+![]() O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO+H2O(l)===Ca(OH)2(s) ΔH8
A. ①③④ B. ②③④ C. ①④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( ) 
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.硫酸中逐滴加入氢氧化钡溶液
D.醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性条件下有以下反应关系:
(i)KBrO3能将KI氧化成I2或KIO3 , 其本身被还原为Br2 .
(ii)Br2能将I-氧化为I2 .
(iii)KIO3能将I-氧化为I2 , 也能将Br-氧化为Br2 , 其本身被还原为I2 .
①上述物质中氧化剂氧化能力由强到弱的顺序是 .
②现向含有1molKI的硫酸溶液中加入含amolKBrO3的溶液,a的取值范围不同,所得产物也不同.试将讨论的结果填入下表.
编号 | a的取值范围 | 产物的化学式或(离子符号) |
A | I2 , Br- | |
B |
| |
C | a= | |
D | I2 , IO3- , Br2 | |
E | a≥ |
③若产物中碘单质和碘酸钾的物质的量相等,a的值为 .
④若a的值为1时,其产物及其物质的量分别为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,许多城市将公共汽车的燃料换成甲醇(CH3OH),以减少汽车尾气对环境造成的污染.
(1)某校研究性学习小组的同学为了探究甲醇在氧气中燃烧的产物,他们将甲醇在氧气中点燃,再用燃烧后的混合气体通过如下的装置进行实验(铁架台等装置已略去): 
请你设计这些装置的连接顺序(装置不重复使用),使实验尽可能多地检验出甲醇燃烧的产物(用装置的编号表示);混合气体→、、→D.
(2)学习小组的同学通过正确的设计并进行实验,在实验过程中观察到的部分现象如下:
D和A中左边装置内的澄清石灰水均变浑浊,而A中右边装置内的澄清石灰水不变浑浊.请结合反应原理和实验现象进行分析,这次实验中甲醇的燃烧产物为 .
(3)通过该实验,请你谈谈应该怎样合理使用燃料 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:步骤1:向废液中加人足量的Nacl溶液,将所得沉淀过滤,并洗涤干净。
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、A1(0H)3和少量仍未反应的AgCl]。取出铝片,过滤并洗涤沉淀。
步骤3:…………
(1)步骤1中检验所加NaCl溶液己经足量的方法是____________。
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体。写出该过程中发生反应的离子方程式:______________________。
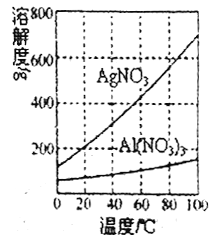
(3)己知AgNO3和Al(N03)3的溶解度曲线如图所示,请补充完整由步骤2中所得灰白色沉淀制取硝酸银晶体的实验方案:向所得灰白色混合物中加入足量______,充分反应后,_____________。向所得沉淀中加入足量________,充分反应后,过滤。 _________ ,得到硝酸银晶体(实验中提供的试剂只有:稀盐酸;稀硝酸、蒸馏水、冰水、酒精溶液)。
(4)己知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
①称取2.000g制备的硝酸银样品,加水溶解,定容到100mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_______________________。
②准确量取25.00mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为________________。
③若滴定前滴定管尖嘴处有气泡,滴定过程中该气泡消失,则所测硝酸银的质量分数_____ (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com