
【题目】回答酸碱滴定实验中的下列问题: 
(1)下列有关滴定操作的顺序正确的是; ①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④滴定操作 ⑤装标准溶液和待测液并调整液面(记录初始读数) ⑥取一定体积的待测液于锥形瓶中
A.①③②④⑤⑥
B.①②③⑤⑥④
C.②③①④⑤⑥
D.④⑤①②③⑥
(2)如图1表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是mL.
(3)如图2表示25.00mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.a mL
B.(25﹣a) mL
C.大于a mL
D.大于(25﹣a)mL
(4)图3为用一标准浓度NaOH溶液滴定20.00mL未知浓度的盐酸时的滴定曲线.则两种溶液的物质的量浓度分别是:c(HCl)= , c(NaOH)= .
(5)滴定过程中,下列操作中会使测定结果偏低的有
A.酸式滴定管未润洗
B.锥形瓶内有少量水
C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定前仰视滴定管读数,滴定后平视刻度读数.
【答案】
(1)B
(2)3.2
(3)D
(4)1.0;0.5
(5)AD
【解析】解:(1)中和滴定有检漏、洗涤、润洗、装液、取待测液加指示剂、滴定等操作,则操作顺序为①②③⑤⑥④
故选:B;(2)由图知量筒A与B之间有五个小格,所以一个小格代表0.2ml,即此量筒的分度值为0.2ml,如果刻度A为4,则刻度A为3,凹液面最低处与3mL以上一个刻度处相平,所以液体体积为3.2mL;
所以答案是:3.2;(3)滴定管刻度值从上到下刻度逐渐增大,由于滴定管最大刻度下方无刻度,50mL滴定管中实际盛放液体的体积大于50ml,如果液面处的读数是a,则滴定管中液体的体积大于(50﹣a)mL,
所以答案是:D.(4)溶液的pH为1,则盐酸过量,过量的盐酸n(盐酸)=C(盐酸)×20.00mL﹣C(氢氧化钠)×30.00mL,则C(H+)= ![]() =10﹣1mol/L;
=10﹣1mol/L;
恰好中和时,C(盐酸)×20.00mL=C(氢氧化钠)×40.00mL,
解方程组得:C(盐酸)=1.0mol/L;C(氢氧化钠)=0.5mol/L;
所以答案是:1.0;0.5;(5)A.酸式滴定管未润洗,待测液被稀释,则待测液的物质的量偏小,造成V(标准)偏小,c(待测)= ![]() 判断,可知c(待测)偏小,故A正确
判断,可知c(待测)偏小,故A正确
B.锥形瓶内有少量水,待测液的物质的量不变,造成V(标准)不变,c(待测)= ![]() 判断,可知c(待测)无影响,故B错误;
判断,可知c(待测)无影响,故B错误;
C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失,造成V(标准)偏大,c(待测)= ![]() 判断,可知c(待测)偏大,故C错误;
判断,可知c(待测)偏大,故C错误;
D.滴定前仰视滴定管读数,滴定后平视刻度读数,造成V(标准)偏小,c(待测)= ![]() 判断,可知c(待测)偏小,故D正确;
判断,可知c(待测)偏小,故D正确;
故选:AD;
【考点精析】解答此题的关键在于理解酸碱中和滴定的相关知识,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物分子中有 n 个CH 2 , m 个 ![]() ,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
A.m﹣a
B.n+m+a
C.m+1﹣a
D.m+2﹣a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
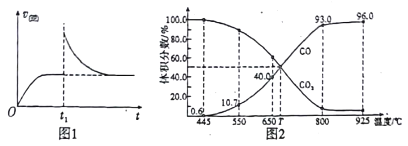
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
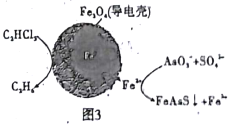
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解法精炼铜的下列说法正确的是( )
A. 粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液
B. 纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液
C. 电解结束后,溶液中Cu2+浓度不变
D. 电解结束后,溶液中Cu2+浓度变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
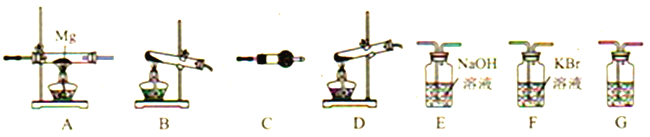
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和D组成化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程 ,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com