
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
【答案】
(1)N2O4?2NO2;>
(2)0.14;0.003mol/L?s
(3)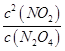 ;0.54
;0.54
(4)ABD
【解析】解:(1)将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,反应的化学方程式为:N2O42NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;依据化学平衡三段式列式计算分析判断;进行到40S和进行到60S时;
N2O4 | 2NO2 | |
起始(mol) | 0.4 | 0 |
转化(mol) | 0.2 | 0.4 |
40s末(mol) | 0.2 | 0.4 |
得到b=0.2mol/L;
进行到60S和进行到60S时;
N2O4 | 2NO2 | |
起始(mol) | 0.4 | 0 |
转化(mol) | 0.22 | 0.44 |
60s末(mol) | 0.18 | 0.44 |
c=0.18 mol/L
计算比较得到,b>c;
所以答案是:N2O42NO2;>;(2)进行到20S;
N2O4 | 2NO2 | |
起始(mol) | 0.4 | 0 |
转化(mol) | 0.12 | 0. 24 |
20s末(mol) | 0.28 | 0.24 |
20s时,N2O4的浓度= ![]() =0.14mol/L;
=0.14mol/L;
0~20s内N2O4的平均反应速率= ![]() =0.003mol/Ls;
=0.003mol/Ls;
所以答案是:0.14;0.003mol/Ls;(3)N2O42NO2,平衡常数K= ![]() ;
;
80°C平衡状态和60S是相同平衡状态,平衡浓度c(NO2)=0.22mol/L,c(N2O4)=0.09mol/L;
平衡常数K= ![]() =
= ![]() =0.54mol/L;
=0.54mol/L;
所以答案是: ![]() ;0.54;(4)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因;
;0.54;(4)反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,说明反应逆向进行,逆向是放热反应,正向是吸热反应;该反应的K值越大,说明平衡正向进行,是温度降低的原因;
A、平衡正向进行N2O4的转化率越高,故A正确;
B、平衡正向进行NO2的产量越大,故B正确;
C、依据上述计算分析平衡正向进行,N2O4与NO2的浓度之比越小,故C错误;
D、该反应的K值越大,说明平衡正向进行,正反应进行的程度越大,故D正确;
所以答案是:ABD.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑨ | |||
4 | ② | ⑥ | ⑩ |
(1)②的元素符号是________。
(2)在①、②、③三种元素中,原子半径由大到小的顺序依次是________。
(3)①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈________。
(4)⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是________,用原子结构理论解释:________。
(5)⑤元素的氢化物实验室制法的化学方程式是________。此反应的能量变化示意图如右图所示,该反应是______反应(选填“放热”或“吸热”),判断依据是______。

(6)对⑥元素的说法正确的是________(填字母)。
a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答酸碱滴定实验中的下列问题: 
(1)下列有关滴定操作的顺序正确的是; ①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④滴定操作 ⑤装标准溶液和待测液并调整液面(记录初始读数) ⑥取一定体积的待测液于锥形瓶中
A.①③②④⑤⑥
B.①②③⑤⑥④
C.②③①④⑤⑥
D.④⑤①②③⑥
(2)如图1表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是mL.
(3)如图2表示25.00mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.a mL
B.(25﹣a) mL
C.大于a mL
D.大于(25﹣a)mL
(4)图3为用一标准浓度NaOH溶液滴定20.00mL未知浓度的盐酸时的滴定曲线.则两种溶液的物质的量浓度分别是:c(HCl)= , c(NaOH)= .
(5)滴定过程中,下列操作中会使测定结果偏低的有
A.酸式滴定管未润洗
B.锥形瓶内有少量水
C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定前仰视滴定管读数,滴定后平视刻度读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏B.分液、蒸馏、萃取
C.萃取、蒸馏、分液D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上镀铜时可用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
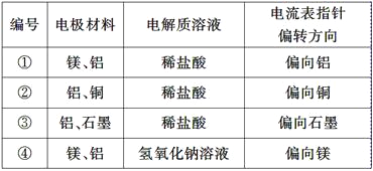
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com