
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑨ | |||
4 | ② | ⑥ | ⑩ |
(1)②的元素符号是________。
(2)在①、②、③三种元素中,原子半径由大到小的顺序依次是________。
(3)①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈________。
(4)⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是________,用原子结构理论解释:________。
(5)⑤元素的氢化物实验室制法的化学方程式是________。此反应的能量变化示意图如右图所示,该反应是______反应(选填“放热”或“吸热”),判断依据是______。

(6)对⑥元素的说法正确的是________(填字母)。
a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤
【答案】 K K Na Mg 黄色 HClO4 S和Cl处在同一周期,电子层数相同,Cl的核电荷数S大于,Cl的原子半径小于S,Cl的得电子能力强于S,Cl的非金属性强于S,所以HClO4酸性较强 NH4Cl + Ca(OH)2 ![]() CaCl2 + NH3↑+ 2H2O 放热反应 反应物能量的总和大于生成物能量的总和 b c
CaCl2 + NH3↑+ 2H2O 放热反应 反应物能量的总和大于生成物能量的总和 b c
【解析】试题根据元素在周期表中的位置,①~⑩十种元素依次是Na、K、Mg、Al、N、As、S、F、Cl、Br;同主族元素从上到下半径最大,同周期元素从左到右半径减小;Na的焰色呈黄色;同周期元素从左到右非金属性增强、氢化物稳定性增强、最高价氧化物对应水化物的酸性增强;实验室中用加热氯化铵与氢氧化钙的混合物制取氨气;放热反应中生成物的总能量小于反应物的总能量;同主族元素从上到下非金属性减弱,氢化物稳定性减弱、最高价氧化物对应水化物的酸性减弱。
解析:根据以上(1)②是钾元素,元素符号是K。(2)同主族元素从上到下半径最大,同周期元素从左到右半径减小,Na、K同主族,半径Na<K,Na Mg同周期,半径Na >Mg,所以半径从大到小的顺序是K Na Mg;(3)NaF中含有钠元素,在高温下灼烧,火焰呈黄色。(4)S和Cl处在同一周期,电子层数相同,Cl的核电荷数S大于,Cl的原子半径小于S,Cl的得电子能力强于S,Cl的非金属性强于S,所以HClO4酸性较强;(5)⑤元素的氢化物是氨气,实验室中用加热氯化铵与氢氧化钙的混合物制取氨气,化学方程式是NH4Cl + Ca(OH)2 ![]() CaCl2 + NH3↑+ 2H2O。根据图示,生成物的总能量小于反应物的总能量,所以该反应是放热反应。(6)a. 同主族元素从上到下非金属性减弱,所以As的非金属性弱于N,故a错误; b.同周期元素从左到右非金属性增强,⑥、⑩同周期,所以氢化物稳定性:⑥<⑩,故b正确; c. ⑥、⑤同主族,同主族元素从上到下非金属性减弱,所以最高价氧化物对应水化物的酸性:⑥<⑤,故c正确;
CaCl2 + NH3↑+ 2H2O。根据图示,生成物的总能量小于反应物的总能量,所以该反应是放热反应。(6)a. 同主族元素从上到下非金属性减弱,所以As的非金属性弱于N,故a错误; b.同周期元素从左到右非金属性增强,⑥、⑩同周期,所以氢化物稳定性:⑥<⑩,故b正确; c. ⑥、⑤同主族,同主族元素从上到下非金属性减弱,所以最高价氧化物对应水化物的酸性:⑥<⑤,故c正确;


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下图中甲—戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应。

(1)上述五种物质中:
①可用于农业生产改良酸性土壤的是_________________。
②能相互发生置换反应的一个化学方程式为_________________________。
(2)若图中乙为H2SO4:
①甲或丙能否为CuSO4?答:_____________(填“可以”或“不可以”)。
②若乙与丁发生中和反应,则丙为_________________。
(3)若丙为铁,则甲与戊反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子中有 n 个CH 2 , m 个 ![]() ,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
A.m﹣a
B.n+m+a
C.m+1﹣a
D.m+2﹣a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式书写不正确的是
A. 向氯化铁溶液中加入铁粉,颜色变浅:Fe3++ Fe ![]() 2Fe2+
2Fe2+
B. 向碳酸钠溶液中滴加稀盐酸,产生气体:CO32-+ 2H+![]() CO2↑ + H2O
CO2↑ + H2O
C. 向氯化钠溶液中滴加硝酸银溶液,生成沉淀:Ag+ + Cl-![]() AgCl ↓
AgCl ↓
D. 向氯化钡溶液中滴加稀硫酸,生成沉淀:Ba2++ SO42-![]() BaSO4 ↓
BaSO4 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿[主要成分MnO2,还含Fe2O3、Cu2(OH)2CO3及少量不溶于水和酸的杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3),生产过程如下图:
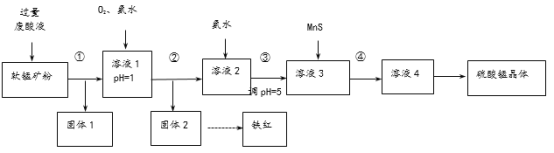
Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 3.6 |
(1)过程①~④所涉及的实验操作方法中,包含过滤的有______(写序号)。
(2)溶液1中,先通入O2,其作用是_______。
(3)由固体2得到铁红的化学方程式是_______。
(4)下列说法正确的是______(填字母)。
a.过程①中有氧化还原反应发生
b.加入MnS的目的是除去溶液中的Cu2+,增大Mn2+
c.溶液1中含有的阳离子主要是Fe2+、Fe3+、Cu2+、Mn2+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组制备氯气并对产生氯气的条件进行探究。
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的______(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是______。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向。____________
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是______。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
实验 | 操作 | 现象 |
I | 常温下将MnO2和12 mol·L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4 mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是________。
②II中发生了分解反应,反应的化学方程式是________。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
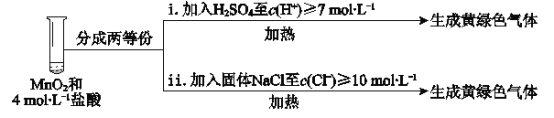
将实验III、IV作对比,得出的结论是________;将i、ii作对比,得出的结论是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
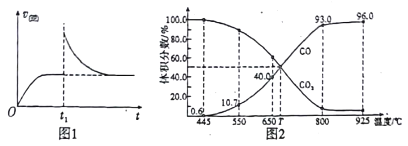
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
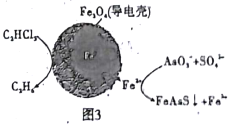
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 .
A.N2O4的转化率越高
B.NO2的产量越大
C.N2O4与NO2的浓度之比越大
D.正反应进行的程度越大.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com