
【题目】下图中甲—戊分别为下述五种物质中的一种:CuSO4、H2SO4、Fe、Na2CO3和Ca(OH)2,且图中相连两个环对应的物质(或其溶液)在常温条件下能发生化学反应。

(1)上述五种物质中:
①可用于农业生产改良酸性土壤的是_________________。
②能相互发生置换反应的一个化学方程式为_________________________。
(2)若图中乙为H2SO4:
①甲或丙能否为CuSO4?答:_____________(填“可以”或“不可以”)。
②若乙与丁发生中和反应,则丙为_________________。
(3)若丙为铁,则甲与戊反应的离子方程式为___________________________。
【答案】 Ca(OH)2 Fe+H2SO4=FeSO4+H2↑或Fe+CuSO4=FeSO4+Cu 不可以 Na2CO3 Ca2++CO32—=CaCO3↓
【解析】(1)①在五种物质中只有氢氧化钙能够改良酸性土壤。
②五种物质中铁可以与硫酸反应生成氢气,铁也可以置换出硫酸铜中的铜,两者均属置换反应。
(2)①硫酸铜不能与硫酸反应。
②中和反应是酸与碱生成盐和水的反应,乙是硫酸所以丁是氢氧化钙,而丙和乙、丁均可以反应,所以丙为碳酸钠。
(3)若丙为铁,由于乙和丁均能与之反应,所以乙和丁是硫酸或硫酸铜,所以甲和戊是碳酸钠和氢氧化钙两种物质。
(1)①在五种物质中只有氢氧化钙能够改良酸性土壤;正确答案:Ca(OH)2。
②五种物质中铁可以与硫酸反应生成氢气,铁也可以置换出硫酸铜中的铜,两者均属置换反应,其方程式分别为:Fe+H2SO4=FeSO4+H2↑或Fe+CuSO4= FeSO4+Cu;正确答案:Fe+H2SO4=FeSO4+H2↑或Fe+CuSO4=FeSO4+Cu。
(2)①由题可知乙为硫酸,而甲与丙均能与乙反应,但硫酸铜不能与硫酸反应,所以甲或丙不能是硫酸铜;正确答案:不可以。
②中和反应是酸与碱生成盐和水的反应,乙是硫酸所以丁是氢氧化钙,而丙和乙、丁均可以反应,所以丙为碳酸钠;正确答案:Na2CO3。
(3)若丙为铁,由于乙和丁均能与之反应,所以乙和丁是硫酸或硫酸铜,所以甲和戊是碳酸钠和氢氧化钙两种物质,两者的反应为:Ca2++CO32—=CaCO3↓;正确答案:Ca2++CO32—=CaCO3↓。


科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是

A. 辛酸的羧酸类同分异构体中,含有三个“-CH3”结构,且存在乙基支链的共有7种
B. 辛酸的同分异构体(CH3)3CCH(CH3)CH2COOH的名称为2,2,3一三甲基戊酸
C. 正辛酸常温下呈液态而软脂酸常温下呈固态,故二者不符合同一通式
D. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)具有强氧化性,是一种重要的化工原料,广泛应用于制革、印染、电镀等工业。以铬酸钾(K2CrO4)和氢氧化钾为原料,用电化学法制备重铬酸钾的实验装置如图所示。已知水溶液中存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。下列说法中正确的是
Cr2O72-+H2O。下列说法中正确的是

A. 气体甲和乙分别为O2和H2
B. 该装置中阴极区的pH减小
C. Fe电极反应式4OH--4e-=O2↑+2H2O
D. 当铬酸钾的转化率达到80%时,右池中![]() =
=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素在自然界中以多种形态存在。
I、下图A、B分别表示金刚石和石墨的结构模型。右表为金刚石和石墨的某些性质:
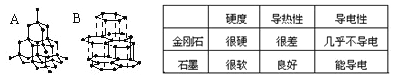
(1)金刚石转化为石墨属于_________变化(填“物理”或“化学”)。
(2)切割玻璃的玻璃刀应选用________________(填“金刚石”或“石墨”)做材料。
(3)根据金刚石和石墨的结构和性质推断,下述观点不正确的是___(填字母)
A.不同物质具有不同的结构 B.不同物质的组成元素一定不同
C.不同物质具有不同的性质 D.物质的结构决定了物质的性质
II、碳酸盐是碳的重要化合物。碳酸钠和碳酸氢钠是应用广泛的两种碳酸盐。
(4)碳酸氢钠在日常生活中的一种用途是____________________。
(5)现有一包白色固体,为检验该粉末是碳酸钠还是碳酸氢钠,某同学设计如下方案开展实验。请根据要求填写空白:
实验操作 | 有关反应的化学方程式 | 实验结论 |
取少许粉末置于试管中加热,并将产生的气体通入澄清石灰水。 | ______________________________________________________________________________ | 该粉末为 碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现。下列有关说法中,正确的是( )
A.H2与H3中不存在氢键B.O2 与O4互为同位素
C.C60 分子中有范德华力D. N5+中含有35个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3-,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是( )
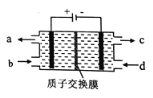
A. H+由左室进入右室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H+-6e-=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化2molHNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO),无色气体,易溶于水,有特殊的刺微气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制Cu(OH)2反应的产物成分,进行如下研究:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5 mol·L-1 NaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器b的名称是____________。
②仪器c的作用为____________。
③能说明甲醛具有还原性的实验现象是____________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。

①依次连接的合理顺序为:A→B→_____→_____→_____→_____→G,________
②装置B的作用是_______________。
③确认气体产物中含H2而不含CO的现象是_________________________。
(3)已知:![]() 。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);

已知:ⅰ.Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) ![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
ⅱ.2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
通过上述实验,可以得出红色固体产物主要是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑨ | |||
4 | ② | ⑥ | ⑩ |
(1)②的元素符号是________。
(2)在①、②、③三种元素中,原子半径由大到小的顺序依次是________。
(3)①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈________。
(4)⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是________,用原子结构理论解释:________。
(5)⑤元素的氢化物实验室制法的化学方程式是________。此反应的能量变化示意图如右图所示,该反应是______反应(选填“放热”或“吸热”),判断依据是______。

(6)对⑥元素的说法正确的是________(填字母)。
a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com