
【题目】某有机物分子中有 n 个CH 2 , m 个 ![]() ,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
A.m﹣a
B.n+m+a
C.m+1﹣a
D.m+2﹣a
【答案】D
【解析】解:某有机物链状分子中含有a个﹣CH3,n 个﹣CH2﹣,m个 ![]() ,其余为OH,说明该物质属于饱和醇,将OH原子换为H原子就是烷烃结构,该分子中C原子个数=(a+n+m),根据烷烃通式知H原子个数=2(a+n+m)+2,a个﹣CH3,n 个﹣CH2﹣,m个
,其余为OH,说明该物质属于饱和醇,将OH原子换为H原子就是烷烃结构,该分子中C原子个数=(a+n+m),根据烷烃通式知H原子个数=2(a+n+m)+2,a个﹣CH3,n 个﹣CH2﹣,m个 ![]() 中H原子总数=3a+2n+m,则缺少的H原子个数=2(a+n+m)+2﹣(3a+2n+m)=m+2﹣a,所以OH个数为m+2﹣a;
中H原子总数=3a+2n+m,则缺少的H原子个数=2(a+n+m)+2﹣(3a+2n+m)=m+2﹣a,所以OH个数为m+2﹣a;
故选D.
该有机物中含有a个﹣CH3,n 个﹣CH2﹣,m个 ![]() ,其余为OH,说明该物质属于饱和醇,将OH原子换为H原子就是烷烃结构,根据烷烃通式计算出H原子个数,计算已知的H原子个数,剩余的就是OH原子个数,据此分析解答.
,其余为OH,说明该物质属于饱和醇,将OH原子换为H原子就是烷烃结构,根据烷烃通式计算出H原子个数,计算已知的H原子个数,剩余的就是OH原子个数,据此分析解答.


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)具有强氧化性,是一种重要的化工原料,广泛应用于制革、印染、电镀等工业。以铬酸钾(K2CrO4)和氢氧化钾为原料,用电化学法制备重铬酸钾的实验装置如图所示。已知水溶液中存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。下列说法中正确的是
Cr2O72-+H2O。下列说法中正确的是

A. 气体甲和乙分别为O2和H2
B. 该装置中阴极区的pH减小
C. Fe电极反应式4OH--4e-=O2↑+2H2O
D. 当铬酸钾的转化率达到80%时,右池中![]() =
=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3-,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是( )
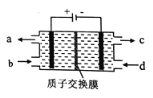
A. H+由左室进入右室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H+-6e-=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化2molHNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO),无色气体,易溶于水,有特殊的刺微气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制Cu(OH)2反应的产物成分,进行如下研究:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5 mol·L-1 NaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器b的名称是____________。
②仪器c的作用为____________。
③能说明甲醛具有还原性的实验现象是____________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。

①依次连接的合理顺序为:A→B→_____→_____→_____→_____→G,________
②装置B的作用是_______________。
③确认气体产物中含H2而不含CO的现象是_________________________。
(3)已知:![]() 。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);

已知:ⅰ.Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) ![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
ⅱ.2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
通过上述实验,可以得出红色固体产物主要是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol/L的氨水滴定10.00mL a mol/L的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。已知N点溶液中存在:c(H+)=c(0H-)+c(NH3H2O),下列说法不正确的是
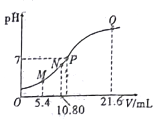
A. 图上四点离子种类相同
B. a=0.108
C. N、Q两点的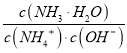 : N>Q
: N>Q
D. M点溶液中存在:c(H+)=c(OH-)+2(NH3H2O) +c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合正确的是( )
选项 | A | B | C | D |
强电解质 | Al2(SO4)3 | BaSO4 | HF | KClO3 |
弱电解质 | H3PO4 | H2O | CaCO3 | Al(OH)3 |
非电解质 | CO2 | NH3·H2O | NH3 | HI |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①~⑩十种元素在周期表中的位置。请用化学用语回答下列问题:
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑨ | |||
4 | ② | ⑥ | ⑩ |
(1)②的元素符号是________。
(2)在①、②、③三种元素中,原子半径由大到小的顺序依次是________。
(3)①、⑧二种元素形成的化合物,在高温下灼烧,火焰呈________。
(4)⑦、⑨二种元素的最高价氧化物对应水化物的酸性较强的是________,用原子结构理论解释:________。
(5)⑤元素的氢化物实验室制法的化学方程式是________。此反应的能量变化示意图如右图所示,该反应是______反应(选填“放热”或“吸热”),判断依据是______。

(6)对⑥元素的说法正确的是________(填字母)。
a. ⑥的非金属性强于⑤
b. 氢化物稳定性:⑥<⑩
c. 最高价氧化物对应水化物的酸性:⑥<⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答酸碱滴定实验中的下列问题: 
(1)下列有关滴定操作的顺序正确的是; ①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④滴定操作 ⑤装标准溶液和待测液并调整液面(记录初始读数) ⑥取一定体积的待测液于锥形瓶中
A.①③②④⑤⑥
B.①②③⑤⑥④
C.②③①④⑤⑥
D.④⑤①②③⑥
(2)如图1表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是mL.
(3)如图2表示25.00mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.a mL
B.(25﹣a) mL
C.大于a mL
D.大于(25﹣a)mL
(4)图3为用一标准浓度NaOH溶液滴定20.00mL未知浓度的盐酸时的滴定曲线.则两种溶液的物质的量浓度分别是:c(HCl)= , c(NaOH)= .
(5)滴定过程中,下列操作中会使测定结果偏低的有
A.酸式滴定管未润洗
B.锥形瓶内有少量水
C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定前仰视滴定管读数,滴定后平视刻度读数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com