
【题目】在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1CuSO4溶液。5 min后,在一个石墨电极上有6.4 gCu生成。试回答下列问题:
(1)发生氧化反应的________极,电极反应式为 ____________________________
(2)发生还原反应的________极,电极反应式为 ____________________________
(3)若将溶液恢复到与电解前一样,则需加入 ________ mol的________________。
(4)若用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ________________g,电解液的pH ________。(填“变小”、“变大”或“不变”)
【答案】阳 4OH- -4e- = O2↑ +2H2O 阴 Cu2+ + 2e- = Cu 0.1 CuO 12.8g 不变
【解析】
在25℃时,用石墨电极电解2.0L 0.5mol/LCuSO4溶液中Cu2+物质的量为2.0L×0.5mol/L =1mol,5min后,在一个石墨电极上有6.4gCu生成物质的量为![]() =0.1mol;
=0.1mol;
(1)电解过程中,溶液中阴离子OH-、SO42-移向阳极,氢氧根离子失电子,发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑;
故答案为:阳; 4OH--4e-═2H2O+O2↑;
(2)电解过程中,溶液中阳离子Cu2+、H+移向阴极得电子,发生还原反应,电极反应:2Cu2++4e-═2Cu;
故答案为:阴;2Cu2++4e-═2Cu;
(3)根据电解的离子方程式2Cu2++2H2O=2Cu+O2↑+4H+,反应生成铜的物质的量为:0.1mol,生成氧气的物质的量为:0.1mol×1/2=0.05mol,根据反应电解后,原溶液相当于减少了0.1molCuO,
故答案为:0.1;CuO;
(4)如用等质量的两块铜片代替石墨作电极,阳极反应为:Cu-2e-=Cu2+;阴极电极反应为:Cu2++2e-=Cu;电子转移0.2mol,阳极减少0.1mol的铜单质,质量为0.1mol×64g/mol=6.4g;同时阴极析出铜6.4g,;电解后两铜片的质量相差12.8g,电解质溶液氢离子和氢氧根离子含量不变,溶液中水的量不变,则溶液的PH不变,
故答案为:12.8;不变。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾![]() 并探究其性质用途。
并探究其性质用途。
资料:![]() 为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生
为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ![]() 制备
制备![]() 夹持、加热等装置略
夹持、加热等装置略![]()
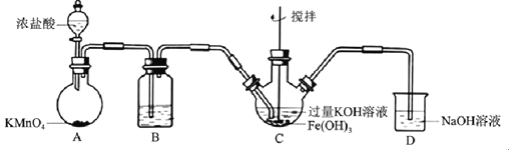
![]() 中所用试剂为______。
中所用试剂为______。
![]() 中反应为放热反应,而反应温度须控制在
中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
![]() 中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
![]() 冰水
冰水![]() 溶液
溶液![]() 异丙醇
异丙醇
Ⅱ![]() 探究
探究![]() 的性质
的性质
![]() 可以将废水中的
可以将废水中的![]() 氧化为
氧化为![]() ,实验表明,
,实验表明,![]() 时
时![]() 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() 。现处理含
。现处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() ______g。
______g。
![]() 资料表明,酸性溶液中氧化性
资料表明,酸性溶液中氧化性![]() 验证实验:将少量
验证实验:将少量![]() 溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入
溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入![]() 和
和![]() 的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有
的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
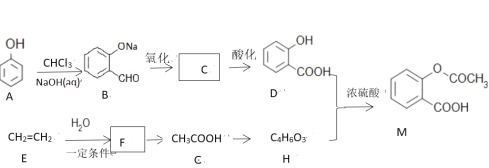
【题目】已知阿司匹林(![]() )是一种常见药物,其中一种合成路线:
)是一种常见药物,其中一种合成路线:
已知:酸酐更易与醇或酚发生酯化反应,已知甲酸酐为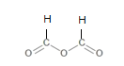
(1)写出M所含官能团名称:______________,E生成F的反应类型为:________________。
(2)写出物质B与银氨溶液的反应方程式:___________________。
(3)物质A生成B的过程中还有可能生成另一种苯环的二取代产物为:___________。
(4)物质B到D先氧化后酸化的原因是:_________________,符合下列条件D的同分异构体有多少种:_________。
a.遇到FeCl3会显紫色 b.可以发生银镜反应
(5)写出D+H→M的反应方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
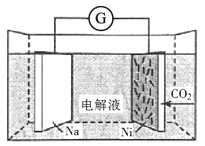
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-=2CO32-+C
D.充电时,阳极反应为Na++e-=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+ O2![]() 2SO3达到平衡的标志是
2SO3达到平衡的标志是
①消耗2 mol SO2的同时生成2 mol SO3
② SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A.①②B.①③C.只有③D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略体积的变化
忽略体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]()
![]() 溶液混合后会有
溶液混合后会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com