
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应:2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2mol SO2 1molO2 | 4mol SO3 | 2molSO2 1mol O2 |
平衡v正(SO2) mol/(L·s) | v1 | v2 | v3 |
平衡c(SO3) mol/L | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(SO2) | a2(SO3) | a3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法不正确的是
A. v1< v2,c2< 2c1 B. v1< v3,α1(SO2 ) >α3(SO2 )
C. K1> K3,p2> 2p3 D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
【答案】AC
【解析】
采用比较的方法分析,对照容器的特点,将容器1和容器2对比,将容器1和容器3对比。
采用比较的方法分析,对照容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2、2molO2,容器2中起始反应物物质的量为容器1的2倍,容器2相当于在容器1达到平衡后增大压强,将容器的体积缩小到原来的一半,增大压强反应速率加快,则v1<v2,增大压强平衡向正反应方向移动,平衡时c2>2c1,p2<2p1,α1(SO2 )+α2(SO2 )<1;容器1和容器2的温度相同,则K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度反应速率加快,则v1<v3,升高温度平衡逆向移动,平衡时c3<c1,p3>p1,α1(SO2 )>α3(SO2 ),K1>K3。
A、根据分析可知,v1<v2,c2>2c1,故A错误;
B、根据分析可知:v1<v3,α1(SO2)>α3(SO2),故B正确;
C、K1>K3,p2<2p1,p3>p1,则p2<2p3,故C错误;
D、c2>2c1,c3<c1,则c2>2c3;α1(SO2 )+α2(SO2 )<1,α1(SO2 )>α3(SO2 ),则α2(SO3 )+α3(SO2 )<1,故D正确;
故选AC。


科目:高中化学 来源: 题型:
【题目】含有相同氧原子数的二氧化硫和三氧化硫,物质的量之比是___,质量之比是___。把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),求混合溶液中C(CuSO4)=_____mol/L,C(SO42-)=___mol/L。将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为____毫升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体,下列说法正确的是( )
白色固体,下列说法正确的是( )
A.①发生了化合反应B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③标准状况下,22.4 L H2O中分子数为NA
④32 g O2和O3混合气体中含有原子数为2NA
A.①②③④B.①②④C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在保证安全的前提下,学以致用是我们化学学习中一直倡导的理念。某同学欲用NaOH固体配制480 mL质量分数为25%,密度为1.2 g·cm-3的溶液,下列说法不正确的是( )
A. 需用托盘天平称量NaOH固体的质量为144 g
B. 容量瓶用蒸馏水洗净后,不必烘干就能用于配制溶液
C. 定容时俯视容量瓶的刻度线,会造成所配制溶液物质的量浓度偏高
D. 该溶液的物质的量浓度约为7.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 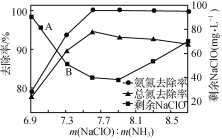 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸为微有桂皮香气的无色针状晶体,能抑制黑色酪氨酸酶的形成,是高级防晒霜中不可少的成分之一。实验室制取肉桂酸的原理如下:

实验步骤:
步骤1 在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2 向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3 在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4 将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5 将晶体在图3所示热水浴上加热干燥。
(1)图1中仪器A的作用是____________。
(2)步骤2中Na2CO3需分批加入的原因是_________________________________________________。
(3)水蒸气蒸馏时,判断蒸馏结束的方法是________。
(4)步骤4中,“趁热过滤”的目的是_____________。
(5)抽滤时所需主要仪器有____、安全瓶及抽气泵等。
(6)与使用烘箱烘干相比,热水浴干燥的优点是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)铁屑加入硝酸银溶液中反应的离子方程式为______。
(2)醋酸(CH3COOH)与烧碱溶液反应的离子方程式为______。
(3)NaHSO4是一种______(填“酸、碱、盐”),向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性时,该反应的离子方程式为_____。
(4)实验室制备少量Fe(OH)3胶体的化学方程式为______。
(5)配平下列方程式:____SO32-+___IO3-+___H+=___SO42-+___I2+___H2O,______
(6)一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com