
【题目】在保证安全的前提下,学以致用是我们化学学习中一直倡导的理念。某同学欲用NaOH固体配制480 mL质量分数为25%,密度为1.2 g·cm-3的溶液,下列说法不正确的是( )
A. 需用托盘天平称量NaOH固体的质量为144 g
B. 容量瓶用蒸馏水洗净后,不必烘干就能用于配制溶液
C. 定容时俯视容量瓶的刻度线,会造成所配制溶液物质的量浓度偏高
D. 该溶液的物质的量浓度约为7.5 mol·L-1
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O ②Cu ③BaCO3 ④Fe(OH)3胶体 ⑤酒精 ⑥CO2 ⑦稀硫酸
(1)以上物质中属于混合物的是________(填序号,下同),属于电解质的是_______。
(2)向④中逐滴滴加⑦,可观察到的现象是_______________________。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(1)右图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是__________(填字母)。

(2)有同学认为所有酸碱中和反应均可表示为:H+ + OH = H2O。请举个例子反驳上述观点(用离子方程式表示)______________________________________。
(3)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag+2H2S+O2 = 2X+2H2O。则 X的化学式为_______。其中H2S是该反应的_______(填序号)。
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:

下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷铜制电路板的腐蚀液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的腐蚀液。
① 腐蚀过程中的离子方程式为______。
![]()
② 腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
i. 步骤I所加试剂和操作分别为______。
ii. 可实现步骤II转化的物质或方法是______(填一种即可)。
(2)研究发现,CuCl2溶液添加盐酸或氨水配制成酸性腐蚀液或碱性腐蚀液,其效果优于FeCl3溶液。腐蚀液的主要成分及腐蚀原理如下:
腐蚀液类型 | 主要成分 | 腐蚀原理 |
酸性腐蚀液 | Cu2+、H+、Cl- | Cu+ Cu2++2Cl- CuCl+2Cl- |
碱性腐蚀液 | Cu(NH3)42+、NH4+、NH3、Cl- | Cu(NH3)42++ Cu === 2Cu(NH3)2+ |

①酸性腐蚀液中铜离子含量对腐蚀速率的影响如右图所示,为保持较快和较平稳的腐蚀速率,腐蚀液中铜离子含量应选择______ g/100mL的使用范围。
②酸性腐蚀废液经过处理后,倒入一定量的水中,可得CuCl沉淀,过滤、洗涤、干燥后即得产品CuCl。倒入一定量的水中,可得CuCl沉淀的原因是_______。
③ 通入适量的氧气可使碱性腐蚀液再生。将该过程的离子方程式补充完整:______________
![]()
(3)H2O2也常用来腐蚀金属铜,使用时加入盐酸或氨水将其配制成酸性或碱性腐蚀液。回收其废液的工艺如下:


① 酸性条件下H2O2腐蚀金属铜的离子方程式为______。
② 右图是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因______。
③ 碱转时的反应为:Cu2(OH)3Cl+NaOH =CuO+Cu(OH)2+NaCl+H2O。检验转化完全的方法是:取少量洗涤后的碱转固体,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:

(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。
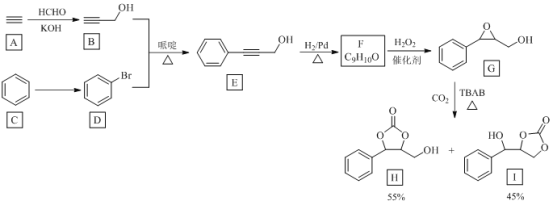
回答下列问题:
(1)由A到B的反应类型为________。
(2)由C到D反应所需试剂为________。
(3)E中官能团的名称是________。
(4)F合成G的反应方程式为________。
(5)H的分子式为________。
(6)写出与G互为同分异构体的羧酸类芳香化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为6:2:1:1)________。
(7)设计由丙炔和甲醛为起始原料制备 和
和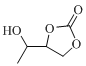 的合成路线 ____(无机试剂任选)。
的合成路线 ____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的价层电子排布图为___________;基态As原子核外能量最高能级的电子云形状为___________。
(2)Si、P、S、Cl的第一电离能由大到小的顺序为___________。
(3M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是___________(填字母)。
a分子空间构型相同 b中心原子杂化类型相同 c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含___________molσ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2 mol AgCl。则T的化学式为______________________。
(4)碳和钨组成一种晶体,其熔点为2870℃,硬度接近金刚石,其晶胞结构如图甲所示,则其化学式为______________________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子所处空间类型为___________(填“立方体”“正四面体”或“正八面体”),空间的填充率为___________。

已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________pm(列式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com