
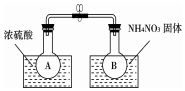
 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.分析 (1)正反应为放热反应,提高NO2转化率,应使平衡正向移动,可增大压强、降低温度等;
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低;
②升高温度平衡向吸热方向移动,降低温度,平衡向放热方向移动;
③根据反应的吸放热确定反应的平衡常数和温度变化之间的关系.
解答 解:(1)A.加入催化剂,平衡不移动,故A错误;
B.升高反应体系的温度,平衡逆向移动,转化率减小,故B错误;
C.降低反应体系的温度,平衡正向移动,转化率增大,故C正确;
D.缩小容器的体积,压强增大,平衡正向移动,转化率增大,故D正确.
故答案为:C、D;
(2)①浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:升高;A中气体颜色加深;
②降低温度,该反应化学平衡移动,即向着正方向移动,故答案为:正;
③反应是放热的,所以升高温度,平衡常数减小,故答案为:减小.
点评 本题考查了化学平衡及其影响,题目难度中等,明确温度对化学平衡的影响为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、HCO3-、Cl- | B. | Fe3+、K+、SO42-、I- | ||
| C. | NH4+、Na+、CO32-、NO3- | D. | Cu2+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)  2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为75% D.反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:填空题
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)溶液呈碱性的有____________(填序号)。
(2)常温下0.01 mol/L HCl溶液的pH=____________;0.01 mol/L NaOH溶液的pH=______________;pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________。
HCl溶液的pH=____________;0.01 mol/L NaOH溶液的pH=______________;pH=11的CH3COONa溶液中由水电离产生的c(OH-) =___________。
(3)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m___________n (填“大于、等于、小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液中加入少量稀硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| B. | NaClO(aq)中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| O═O | H-H | H-O(g) | ||
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x | |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com