
����Ŀ�������£���0.100mol��L-1NaOH��Һ�ֱ�ζ�20.00mL0.100mol��L-1������ʹ��ᣬ�ζ�������ͼ�������Ƿ�Ӧ����ЧӦ������˵����ȷ����

A. ���ߢ��ʾ���ǵζ����������
B. �ζ���������У���Һ�� ����
����
C. V(NaOH)=10.00mLʱ��������Һ��c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. V(NaOH)=20.00mLʱ��������Һ��c(Cl-)>c(CH3COO-)
���𰸡�D
��������A�����ߢ��ʾ���ǵζ���������ߣ�������������ʣ�ͻ�䷶ΧС����A����B���ζ���������У���Һ��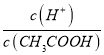 =
=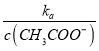 ���¶Ȳ��䣬Ka�Ƕ�ֵ��
���¶Ȳ��䣬Ka�Ƕ�ֵ�� ![]() ���
��� 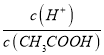 =
=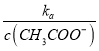 ��С����B����C�� V(NaOH)=10.00mLʱ����Һ�൱���ǵ�Ũ�ȴ���ʹ����ƵĻ�������������ˮ�⣬������Һ��c(CH3COO-)>c(Na+)>c(H+)>c(OH-)����C����D��V(NaOH)=20.00mLʱ��������Һ��NaCl��CH3COONa��ȣ�CH3COONa����ˮ�⣬c(Cl-)>c(CH3COO-)����D��ȷ����ѡD��
��С����B����C�� V(NaOH)=10.00mLʱ����Һ�൱���ǵ�Ũ�ȴ���ʹ����ƵĻ�������������ˮ�⣬������Һ��c(CH3COO-)>c(Na+)>c(H+)>c(OH-)����C����D��V(NaOH)=20.00mLʱ��������Һ��NaCl��CH3COONa��ȣ�CH3COONa����ˮ�⣬c(Cl-)>c(CH3COO-)����D��ȷ����ѡD��


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ij��Ӧ�����淴Ӧ�Ļ�ֱܷ�ΪEakJ/mol��EbkJ/mol�����H=-(Ea-Eb)kJ/mol
B. H2����ֵΪ142.9kJ/g������2H2 (g)+O2(g)=2H2O (l) ��H=-285.8kJ/mol
C. ��Ũ��Ϊ0.1mol/LHF��Һ��ˮ����ϡ�����У�  ʼ�ձ��ּ�С
ʼ�ձ��ּ�С
D. ���ǰ![]() ��������Ļ�Ϻ���Һ�У�
��������Ļ�Ϻ���Һ�У� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨϡ�����ϡ���������к��ȵ�ʵ��װ����ͼ��ʾ��ij��ȤС���ʵ����ֵ�������57.3 kJ��mol��1���к��ȣ���ԭ�������

A. ʵ��װ����С�ձ����е��ڴ��ձ�����
B. ��Ũ���������ϡ����
C. �ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D. ���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�δϴ�ӣ�ֱ�ӲⶨH2SO4��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2���Ǽ�������ˮ�Ҳ���ˮ������ѧ��Ӧ�Ļ���ɫ���壬�е�Ϊ11�棬�����ڴ��������ˮ��ijС����ʵ������̽��ClO2��Na2S�ķ�Ӧ���ش��������⣺
(l)ClO2���Ʊ�������֪��SO2+2NaClO3+H2SO4=2ClO2��+2NaHSO4��

��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ_______________��
�����ռ������ClO2��ѡ����ͼ�е�װ�ã�������˳��Ϊ a��_________(������������Сд��ĸ��ʾ)
��װ��D��������_________��
��2��ClO2�� Na2S �ķ�Ӧ
�������ռ�����ClO2�� N2ϡ������ǿ���ȶ��ԣ�����������ϡ�ͺ��ClO2ͨ����ͼ��ʾװ���г�ַ�Ӧ���õ���ɫ������Һ��һ��ʱ���ͨ������ʵ��̽�� I �з�Ӧ�IJ��

�������� | ʵ������ | ���� |
ȡ����������Һ���Թܼ��У� ����Ba(OH)2��Һ���� | ��_________ | ��������������� |
��ȡ����������Һ���Թ����У� �μ�Ʒ����Һ������ | Ʒ����Һ����ɫ | �� ��_____���� |
�����Թܼ��м�����Ba(OH)2��Һ�� ���������ã�ȡ�ϲ���Һ���Թܱ���______ | �а�ɫ�������� | ��Cl-���� |
��ClO2��Na2S��Ӧ�����ӷ���ʽΪ__________�����ڴ��������ˮʱ��ClO2�����Cl2���ŵ���____________(��д2��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������Ԫ��A��B��C��D��E��ԭ��������������
��C�ļ���̬�⻯����ʪ��ĺ�ɫʯ����ֽ����ɫ��
��A��D�����γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1������Һ̬������X��Y��A��Eͬ���壬C��B��D���ڣ�
��A��B��C��D����Ԫ�����һ�ֻ�����F�������ԭ����֮��Ϊ5��1��1��3��
��ش��������⣺
��1��Cԭ�������ڱ���λ��Ϊ___________��д��������EDA�ĵ���ʽ________��
��2��C������������Ӧ��ˮ����������̬�⻯�ﷴӦ�������Σ�д���仯ѧʽ________��
��3��F��Һ������EDA��ϡ��Һ��ϼ��ȣ������ӷ���ʽΪ_____________________��
��4��������C�ļ���̬�⻯�������а��̼�C2���ɣ�д����Ӧ����ʽ_____________��
��5����CH4������������β���е����������Ⱦ��
��֪��CH4(g)��2NO2(g)![]() N2(g)��CO2(g)��2H2O(l) ��H����955 kJ��mol��1
N2(g)��CO2(g)��2H2O(l) ��H����955 kJ��mol��1
2NO2(g)![]() N2O4(g)�� ��H����56.9 kJ��mol��1
N2O4(g)�� ��H����56.9 kJ��mol��1
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϳɾ������½ṹ�����������ӣ������й�˵������ȷ����(����)
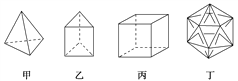
A. 1 mol�����ں���12mol���ۼ� B. ���ҷ��ӹ��ɵ������ܷ���������Ӧ
C. �����ӵĶ���ȡ������ֻ������ D. ���Ӷ���Ȼ�Dz����ܺϳɵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�Ӧ2AB(g)![]() A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A2(g)��B2(g)�ﵽƽ��״̬�ı�־��
A. ��λʱ��������nmolA2��ͬʱ����2n molAB
B. �����ڣ�3������AB��A2��B2����
C. AB���������ʵ���A2����������
D. �����и���ֵ������������ʱ��仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����Ϊ2 L���ܱ������н��з�Ӧ��2A(g)![]() 3B(g)��C(g)������Ӧ����ǰ20 s��3 mol��Ϊ1.8 mol����ǰ20 s��ƽ����Ӧ����Ϊ( )
3B(g)��C(g)������Ӧ����ǰ20 s��3 mol��Ϊ1.8 mol����ǰ20 s��ƽ����Ӧ����Ϊ( )
A. v(B)��0.03 mol��L��1��s��1
B. v(B)��0.045 mol��L��1��s��1
C. v(C)��0.03 mol��L��1��s��1
D. v(C)��0.06 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����Ҫ�Ļ����л�����ԭ�ϣ���ҵ�����ұ���C6H5-CH2CH3��Ϊԭ�ϣ����ô�����ķ�����ȡ����ϩ��C6H5-CH=CH2���ķ�Ӧ����ʽΪ��C6H5-CH2CH3(g)![]() C6H5-CH=CH2(g) +H2(g)��H=a kJmol��1
C6H5-CH=CH2(g) +H2(g)��H=a kJmol��1
��1�������ΪVL���ܱ������г���n mol�ұ�����Ӧ�ﵽƽ��״̬ʱ��ƽ����ϵ���(���ʵ�������)���¶ȵĹ�ϵ��ͼ��ʾ��

600��ʱ���÷�Ӧ��ƽ�ⳣ��_____________��
��2���ұ����ض������·����������⣺
C6H5-CH2CH3(g)+1/2O2(g)![]() C6H5-CH=CH2(g)+H2O(g) ��H1
C6H5-CH=CH2(g)+H2O(g) ��H1
��֪ H2��ȼ���Ȧ�H= b kJ/mol��ˮ��������Ϊc J/g���� ��H1=____________��
(3���������ϰ�װ��Ԫ��ת������ʵ�ַ�Ӧ��2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ��H<0����÷�Ӧ��_________ (����¡��������¡����κ��¶ȡ�)�����Է����С���ij�¶��£�2L �ܱ������г���NO��CO��0.4mol���з�Ӧ�����NO���ʵ����仯��ͼ��ʾ��5����ĩ��Ӧ�ﵽƽ�⡣��6���Ӽ�������0.2 mol NO��0.2 mol CO��0.2 mol CO2��0.3 mol N2������ͼ�л�����9����ĩ��Ӧ�ﵽƽ��NO�����ʵ�����ʱ��ı仯����_________��
N2(g)+2CO2(g) ��H<0����÷�Ӧ��_________ (����¡��������¡����κ��¶ȡ�)�����Է����С���ij�¶��£�2L �ܱ������г���NO��CO��0.4mol���з�Ӧ�����NO���ʵ����仯��ͼ��ʾ��5����ĩ��Ӧ�ﵽƽ�⡣��6���Ӽ�������0.2 mol NO��0.2 mol CO��0.2 mol CO2��0.3 mol N2������ͼ�л�����9����ĩ��Ӧ�ﵽƽ��NO�����ʵ�����ʱ��ı仯����_________��

��4�������ﲢ�Ǿ��Բ��ܣ�����ˮ�����ֲ�ͬ����Һ���ܽ��������ͬ��ͬ����ЧӦ���������γɵȶ���ʹ��������ܽ�������ı䡣��֪AgCl+Cl-�T[AgCl2]-����ͼ��ij�¶���AgCl��NaCl��Һ�е��ܽ������
��������Ϣ��֪��
����ͼ֪���¶���AgCl���ܶȻ�����Ϊ_________��
��AgCl��NaCl��Һ�е��ܽ������ͼ��ʾ������ȱ�С����ԭ���ǣ�_______________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com