
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2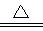 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式 ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 。
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,电池放电时负极发生的反应为Li
FePO4之间的转化,电池放电时负极发生的反应为Li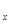 C6-
C6-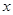 e—
e—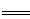
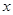 Li++6C,写出电池放电时反应的化学方程式 。
Li++6C,写出电池放电时反应的化学方程式 。
(1)6Li+N2 2Li3N (2分)
2Li3N (2分)
(2)LiNH2 (2分) 11.4 (2分)
(3)Li2CO3+FeC2O4·2H2O+SiO2 Li2FeSiO4+CO↑+2CO2↑+2H2O(2分)
Li2FeSiO4+CO↑+2CO2↑+2H2O(2分)
防止二价铁被氧化(2分)
(4)Fe+H2PO4-+Li+-2e- LiFePO4+2H+(或Fe-2e-
LiFePO4+2H+(或Fe-2e- Fe2+)(2分)
Fe2+)(2分)
(5)Li1-xFePO4+LixC6 LiFePO4+6C(2分)
LiFePO4+6C(2分)
解析试题分析:(1)氮分子的结构很稳定,破坏分子中氮原子之间共价键需要很大的能量,所以,在通常情况下,氮气的化学性质很不活泼,很难跟其他物质发生化学反应。但在高温或放电条件下,当氮分子获得了足够的能量时,它还是能跟氢气、氧气、金属等物质发生化学反应。在高温时,氮气能跟钾、钠、镁、钙、锶、钡等金属化合。所以6Li+N2 2Li3N。
2Li3N。
(2)根据反应Li3N+2H2 LiNH2+2LiH可判断:Li2NH中N的化合价为-3价,H为+1价,LiNH2中N的化合价为-3价,H为+1价,LiH中H的化合价为-1价,反应中H2既是氧化剂又是还原剂,氧化产物为LiNH2,还原产物为LiH;1mol Li3N可与2mol H2反应,因此储存氢气的质量比为(7×3+14):4;相当于Li3N质量的4/35=11.4%。
LiNH2+2LiH可判断:Li2NH中N的化合价为-3价,H为+1价,LiNH2中N的化合价为-3价,H为+1价,LiH中H的化合价为-1价,反应中H2既是氧化剂又是还原剂,氧化产物为LiNH2,还原产物为LiH;1mol Li3N可与2mol H2反应,因此储存氢气的质量比为(7×3+14):4;相当于Li3N质量的4/35=11.4%。
(3)草酸亚铁晶体FeC2O4·2H2O可以联想草酸的性质,H2C2O4═H2O+CO↑+CO2↑,可推测FeC2O4在密闭容器中高温分解生成氧化亚铁、一氧化碳和二氧化碳,根据原子守恒配平即可。得到Li2CO3+FeC2O4·2H2O+SiO2 Li2FeSiO4+CO↑+2CO2↑+2H2O。制备Li2FeSiO4的过程必须在惰性气体氛围中进行,肯定是排除氧气,防止氧化,这个里面只有二价铁有还原星,所以其原因是防止二价铁被氧化。
Li2FeSiO4+CO↑+2CO2↑+2H2O。制备Li2FeSiO4的过程必须在惰性气体氛围中进行,肯定是排除氧气,防止氧化,这个里面只有二价铁有还原星,所以其原因是防止二价铁被氧化。
(4)将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,铁做阳极,先失去电子,Fe-2e- Fe2+,再根据电解析出磷酸亚铁锂沉淀.二价铁再结合H+与H2PO4-生成磷酸亚铁锂,所以电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+(或Fe-2e-
Fe2+,再根据电解析出磷酸亚铁锂沉淀.二价铁再结合H+与H2PO4-生成磷酸亚铁锂,所以电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+(或Fe-2e- Fe2+)。
Fe2+)。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,正极Li
FePO4之间的转化,正极Li FePO4+
FePO4+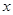 Li++
Li++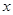 e-
e- LiFePO4,电池放电时负极发生的反应为Li
LiFePO4,电池放电时负极发生的反应为Li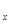 C6-
C6- e—
e—
 Li++6C,正极加上负极就得到电池放电时反应的化学方程式Li1-xFePO4+LixC6
Li++6C,正极加上负极就得到电池放电时反应的化学方程式Li1-xFePO4+LixC6 LiFePO4+6C。
LiFePO4+6C。
考点:考查电化学等综合知识。


科目:高中化学 来源: 题型:单选题
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式:MnO4-+NO2-+X —— Mn2++NO3-+H2O , 下列叙述中正确的是
| A.该反应中NO2-被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1 mol NaNO3需消耗0.4 mol KMnO4 |
| D.X表示的粒子是OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是( )。
| A.在很多反应中IBr是强氧化剂 |
| B.IBr与水反应时既作氧化剂,又作还原剂 |
| C.IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D.IBr与NaOH溶液反应时,生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4,2Na2O2+2SO3=2Na2SO4+O2,据此你认为下列反应方程式中不正确的是( )
| A.Na2O2+N2O3=NaNO2+NaNO3 |
| B.Na2O2+2NO2=2NaNO2+O2 |
| C.Na2O2+N2O4=2NaNO3 |
| D.2Na2O2+2Mn2O7=4NaMnO4+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部加紧调查巨能钙。下列有关说法错误的是( )
| A.H2O2、Na2O2都属于过氧化物,都存在共价键 |
| B.双氧水是绿色氧化剂,可作医疗消毒剂 |
| C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 |
| D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42—>IO3—>I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )。
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.在反应CaH2+2H2O=Ca(OH)2+2H2↑中,水作氧化剂 |
| C.反应3NO2+H2O=2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )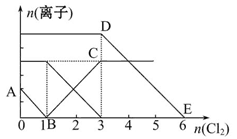
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)="6" mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
| A.反应①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
| B.根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3 |
| C.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
| D.可以推理得到Cl2+FeBr2 =FeCl2+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com