
【题目】乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是

A. 若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为2 mol
B. M电极上的电极反应式为:2Cl 2e =Cl2↑
C. 电解一段时间后,N极附近溶液的pH变大
D. M极与电源的负极相连
【答案】D
【解析】
A、2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于两极均有乙醛酸生成,所以生成的乙醛酸为2mol,故A正确;
B、M为阳极,氯离子失去电子,M电极上的电极反应式为:2Cl 2e =Cl2↑,故B正确;
C、N电极上HOOC-COOH得电子生成HOOC-CHO,则电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,消耗氢离子,电解一段时间后,N极附近溶液的pH变大,故C正确;
D、根据质子的移动方向,确定M电极是阳极,M极与直流电源的正极相连,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置关系如图所示。下列判断正确的是
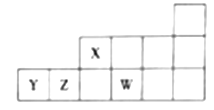
A. 原子半径:rW>rZ>rY>rX
B. 最高价氧化物对应水化物的酸性:Z>X>Y
C. X、Z、W形成的简单氢化物中X的氢化物沸点最高
D. W与Y元素形成的化合物在水溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应2X(g)+Y(g)![]() Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )
Z(s)+3W(g) ΔH<0。达到平衡后,t1时刻改变某一条件所得vt图像如图,则改变的条件为( )

A. 增大压强B. 升高温度C. 加催化剂D. 增大生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:

(1)要将洗出液中的溶质析出,采用的方法是_________。
A.蒸发结晶 B.冷却结晶
C.先蒸发,再冷却结晶 D.先冷却,再蒸发结晶
(2)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________________________。
(3)蒸发时用到的硅酸盐仪器有____________________________________________________。
(4)上述流程中加入NaOH溶液,反应的离子方程式是_______________________________。
(5)硅酸钠溶液呈____性,硅酸钠的用途很广,其中的一种用途是_______________________。
(6)将用上流程中的残渣来焊接铁轨,反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机化学中是非常普遍的,下列有机化合物不是同分异构体的一组是( )
①CH2=CHCH3②![]() ③CH3CH2CH3④CH3CH2CH=CH2⑤
③CH3CH2CH3④CH3CH2CH=CH2⑤![]() ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3
A. ①和②
B. ①和③
C. ④和⑥
D. ⑤和⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0mol·L-1的NaOH溶液230mL:
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A.计算 B.称量 C.__ D.冷却 E.__ F.__ G.定容 H.摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有___,使用该仪器前必须进行的一步操作是___。
(3)需称量___g烧碱固体,固体应该放在___中称量。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是__。
A.没有洗涤烧杯和玻璃棒
B.转移溶液时不慎有少量洒到容量瓶外面
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视刻度线
E.未冷却到室温就将溶液转移到容量瓶并定容
(5)若从所配制溶液取出100mL,再将这100mL溶液加水稀释成1L的溶液,则稀释后所得溶液的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学常见的几种物质①NaOH溶液②铜丝③液氯④盐酸⑤稀硫酸⑥氨水⑦CO2⑧熔融NaCl⑨蔗糖晶体⑩酒精。属于非电解质的是________,属于电解质的是________。
(2)工业上可用浓氨水检查氯气管道是否漏气。若有Cl2漏出,与浓氨水接触会有白烟生成,同时产生一种无毒、无可燃性、不污染大气的气体。有关的化学方程式是________:。该反应中氧化剂和还原剂的物质的量之比为________。
(3)铁酸钠(Na2FeO4)是水处理过程中一种新型的净水型,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
①配平制取铁酸钠的化学方程式:____Fe(NO3)3+____NaOH+ ____Cl2——____Na2FeO4 +____NaNO3+____NaCl+____H2O
②用单线桥法标出反应中电子转移的方向和数目____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com