
【题目】用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积。下列选项中可正确表示实验X及Y的结果是
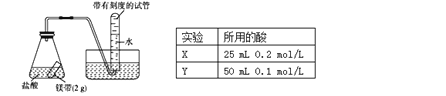
A.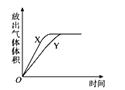 B.
B.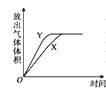
C.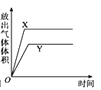 D.
D.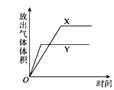
科目:高中化学 来源: 题型:
【题目】(1)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是___,被氧化的元素是___。
(2)在反应MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是___;被氧化的HCl的物质的量为___。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是___;被氧化的HCl的物质的量为___。
(3)在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O。该反应中还原剂为___,RO3n-中R元素的化合价是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数依次增大的前四周期五种常见元素X、Y、Z、W、R,其相关信息如下:X的原子结构中,最外层电子数是内层电子数的2倍;Z形成的多种同素异形体,其中之一是地球生物的“保护伞”;W的一种单质是黄色粉末,难溶于水,易溶于二硫化碳;R单质在氯气中燃烧会产生棕黄色的烟,该烟溶于少量水中显绿色。
(1)X在元素周期表中的位置:______,该族元素易形成______(填写“离子”或“共价”)化合物。
(2)Y的简单氢化物遇到![]() 可以产生白烟现象,化工上常利用该性质检查氯气,该反应方程式为________。写出该“白烟”的电子式:________。
可以产生白烟现象,化工上常利用该性质检查氯气,该反应方程式为________。写出该“白烟”的电子式:________。
(3)写出Y与Z形成的化合物对环境的影响:__________(写出一条即可)。
(4)Z的一种氢化物可以使酸性高锰酸钾溶液褪色,其原因是__________(用离子方程式表示)。
(5)W的简单氢化物与Z的单质在烧碱溶液中可以形成燃料电池(产物中无沉淀生成),写出负极反应式:____________。
(6)![]() 投入足量的某浓度的硝酸中,所得气体产物为NO和
投入足量的某浓度的硝酸中,所得气体产物为NO和![]() 的混合物,且体积比为1:1,发生反应的化学方程式为:_____________。
的混合物,且体积比为1:1,发生反应的化学方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO42-的物质的量之比为( )
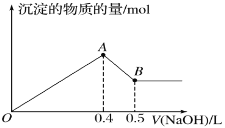
A.3∶1B.4∶1C.5∶1D.6∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
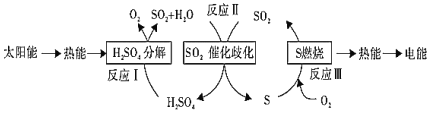
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
写出反应Ⅱ的热化学方程式:_____________________。
(2)歧化反应可简单理解为化学反应中同一反应物中某元素化合价同时出现升降。已知I-离子可以作为水溶液中SO2歧化反应的催化剂。有关离子方程式如下(未配平):
a.SO2+I-+H+→S↓+I2+H2O
b.I2+H2O+SO2→SO42-+H++I-
i.依据图示及以上离子方程式a、b,写出SO2歧化反应方程式:______________。
ii.探究a、b反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
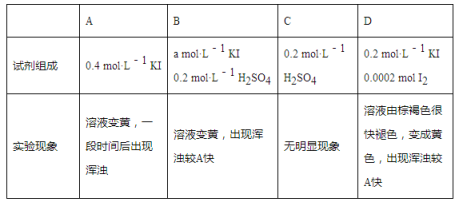
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合①、②反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同温、同浓度时,酸性:H2SO3>H2CO3>HSO3- >HCO3-
【1】用方程式表示NaHSO3溶液中存在的三个平衡体系(不考虑亚硫酸的分解):
①_________、②_________、③_________。
【2】0.1 mol L-1 的 NaHSO3溶液中离子浓度:c(SO32-)______c(HSO3-)(填 “>”、“<”或“=”);要使其中的c(H+)和c(SO32-)都减小,可行的方法是________________。
A 加入过量CaO(s) B 加入少量NaOH(s) C 通入过量HCl(g) D 加入少量的H2O2(aq)
【3】0.1mol L的Na2SO3溶液呈____性(填“酸”、“碱”或“中”),其电荷守恒式: c(Na+)+c(H+)=_______。
【4】H2SO3和NaHCO3溶液的离子方程式为:___________。
【5】NaHSO3溶液在不同温度下均可被过量KIO3酸性溶液氧化,当NaHSO3完全消耗即I2有析出,写出该反应的离子方程式:___________。
【6】将NaHSO3(含少量淀粉)和酸性溶液KIO3(过量)混合,记录10-50℃间溶液变蓝时间,实验結果见下图。请描述曲线变化的规律________。
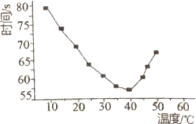
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示,下列说法正确的是( )

A. 铝球表面有气泡产生,溶液中有白色沉淀生成;杠杆不平衡
B. 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出;溶液蓝色变浅,杠杆右边下沉
C. 反应后去掉两烧杯,杠杆仍平衡
D. 右边球上出现红色,左边溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置,并用单线桥法标明电子转移的方向和数目。________________
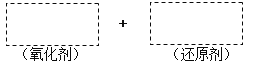
(2)生成2 mol的HIO3转移的电子数为___________
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成I的是_____(选填序号)
a.盐酸 b.硫化氢 c.溴化钠 d.硫酸亚铁
(4)若向H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com