
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ���ʳ�γ���������Ca2+��Mg2+��Fe3+��SO42-���������ӣ�ʵ�����ᴿNaC1���������£�
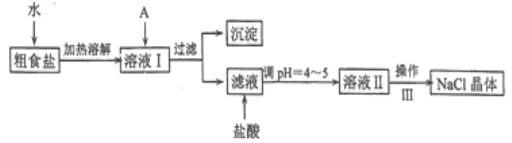
(1) ����A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42-���ӡ�A�������Ƕ����Լ������μ�˳������Ϊ:i��NaOH������_____������_______(�ѧʽ)��
(2) ��ͼ��ijѧ���Ĺ��˲���ʾ��ͼ��������淶����___________(����)��
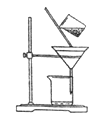
a.©��ĩ�˾���δ�����ձ���
b.��������������
c.����ֽʪ��ʹ�����©����
d.��ֽ��Ե�߳�©��
e.�ò�������©������������Լӿ�����ٶ�
(3) ����III��������___��
(4) mg�����ᴿ��õ�ng������NaCl���壬��m��n�Ĵ�С��ϵΪ__��
A.m>n B.m<n C.m=n D.��ȷ��.
(5) ʵ����������480 mL0.400mol/L���ᣬ������ͼ��ʾŨ�������ƣ��ش���������:
����
����ʽ: HCl
��Է�������: 36.5
�ܶ�: 1.2g/cm3
HCl����������Ϊ: 36.5%
����ȡŨ��������Ϊ:______mL��(�������1λС��)
���𰸡�BaCl2 Na2CO3 bc �����ᾧ D 16.7
��������
(1)����A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42���ӡ�Ҫ�����������Ҫ�Ȼ���������þ���ӡ���������Ҫ�������ơ�������������Ҫ̼���ƣ�����ʱ��Ҫ����ӹ��������ʣ���˹����ı�������Ҫ��̼���Ƴ��������̼����Ҫ�����Ȼ������档
(2)©��ĩ�˾���δ�����ձ��ڣ�����Ҫ�����ձ��ڣ���������������������Һ�彦����
����ֽʪ��ʹ�����©���ڣ���ֽ��Ե���ܸ߳�©�����ò�������©������ʱ�����ܽ����Լӿ�����ٶȡ�
(3)����III�Ǵ���Һ�еõ����壬����������������ᾧ��
(4)mg���β�����ж������ʣ������ٳ��ӹ�����Ҳ�������Ȼ��Ƶ�����������ᴿ��õ�ng������NaCl���壬��ȷ��m��n�Ĵ�С��ϵ��
(5)�����Ũ�����Ũ�ȣ��ٸ�����Һϡ�Ͷ��ɵõ���Ҫ��Ũ����������
(1)����A�Լ�����Ϊ�˳�ȥ��ҺI�е�Ca2+��Mg2+��Fe3+��SO42���ӡ�Ҫ�����������Ҫ�Ȼ���������þ���ӡ���������Ҫ�������ơ�������������Ҫ̼���ƣ�����ʱ��Ҫ����ӹ��������ʣ���˹����ı�������Ҫ��̼���Ƴ��������̼����Ҫ�����Ȼ������棬���Եμ�˳������Ϊ:i��NaOH������BaCl2������Na2CO3���ʴ�Ϊ��BaCl2��Na2CO3��
(2)aѡ�©��ĩ�˾���δ�����ձ��ڣ�����Ҫ�����ձ��ڣ���a���淶�����������⣻
bѡ���������������������Һ�彦������b�����淶���������⣻
cѡ�����ֽʪ��ʹ�����©���ڣ���c�����淶���������⣻
dѡ���ֽ��Ե���ܸ߳�©������d�������淶�����������⣻
eѡ��ò�������©������ʱ�����ܽ����Լӿ�����ٶȣ���e�������淶�����������⡣
������������Ϊbc��
(3)����III�Ǵ���Һ�еõ����壬����������������ᾧ���ʴ�Ϊ�������ᾧ��
(4)mg���β�����ж������ʣ������ٳ��ӹ�����Ҳ�������Ȼ��Ƶ�����������ᴿ��õ�ng������NaCl���壬��ȷ��m��n�Ĵ�С��ϵ����D��ȷ��
(5)�����Ũ�����Ũ��Ϊ![]() ���ٸ�����Һϡ�Ͷ��ɵõ���12molL-1V = 0.4 molL-1��0.5L�����V = 0.0167L = 16.7mL���ʴ�Ϊ��16.7��
���ٸ�����Һϡ�Ͷ��ɵõ���12molL-1V = 0.4 molL-1��0.5L�����V = 0.0167L = 16.7mL���ʴ�Ϊ��16.7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʾ���з�Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.������ϡ���2Fe+6H+=2Fe3++3H2��
B.�Ȼ�����Һ�мӹ�����ˮ��Al3++3NH3H2O=Al��OH��3��+3NH4+
C.̼�������Һ�м������������Ʋ����ȣ�NH4++OH��![]() H2O+NH3��
H2O+NH3��
D.����ͨ��ˮ�У���Һ�����ԣ�Cl2+H2O2H++Cl��+ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й������ĸ����õ绯ѧװ�õ�������ȷ����(����)
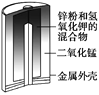
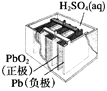
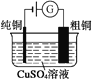
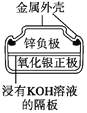
ͼ1������п�̵�� ͼ2��Ǧ���������� ͼ3����⾫��ͭ ͼ4����пŦ�۵��
A. ͼ1��ʾ����У�MnO2�������Ǵ���
B. ͼ2��ʾ��طŵ�����У�����Ũ�Ȳ�������
C. ͼ3��ʾװ�ù��������У��������Һ��Cu2+Ũ��ʼ�ղ���
D. ͼ4��ʾ����У�Ag2O������������ع��������л�ԭΪAg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N��P��Ti��Ԫ����ɵ����Ͳ������Ź㷺����;����ش��������⡣
(1)��Ԫ�ػ�̬ԭ��δ�ɶԵ�����Ϊ____����������ߵĵ���ռ�ݵ��ܼ�����Ϊ__��
(2)��һ��ͬ�������塪����(P4)�����幹��Ϊ____���Ʋ�����CS2�е��ܽ��____������ڡ���С�ڡ�����ˮ�е��ܽ�ȡ�
(3)������������̬�⻯���(PH3)�Ͱ�(NH3)�ļ��Ƿֱ�Ϊ93.6���107�㣬�Է���PH3�ļ���С��NH3��ԭ��________��
(4)��ҵ���ƽ����Ѳ��ý�����ԭ���Ȼ��ѡ��Ƚ�TiO2������Ȼ�Ľ��ʯ��������̿�ۻ�ϼ�����1000��1100K�������Ȼ�����������TiCl4��д������TiCl4�Ļ�ѧ��Ӧ����ʽ��______��
(5)��һ�ֵ����Ѿ���ľ�����ͼ��ʾ���þ���Ļ�ѧʽΪ____����֪������ܶ�Ϊpg��cm-3�������ӵ�����ΪNA�����߳�Ϊ____cm���ú�p��NA��ʽ�ӱ�ʾ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1�����������ʣ��������� ������ ��̼������ ����������
�������ε���________������ţ���д������������ˮ��Һ�еĵ��뷽��ʽ__________��
��������������һ���������������ʾ��ܷ�Ӧ����������__________������ţ���
��2�����������£�������(H3PO2)�ɷ������з�Ӧ�����ڻ�ѧ������
��Ag++��H3PO2+�� =��Ag+��H3PO4+��
�Իش���������
�ٸ÷�Ӧ������������_________��
���뽫��Ӧ��������ﲹ����������ƽ������˫���ŷ��������ת�Ƶ���Ŀ��______
������Ӧ������10.8gAg,��ת�Ƶ��ӵ���ĿԼΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС������������о�����ˮ��Ӧ���ù������ʵijɷ֡����ʼ���������ʵ��̽��������ͬ�ش��������⣺
̽��һ�����ͼ��ʾװ�ý���������ˮ��Ӧ����ʵ��(�г�������)��
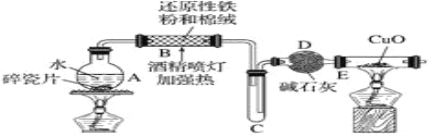
(1)Ӳ�ʲ�����B�з�����Ӧ�Ļ�ѧ����ʽΪ____________��
(2)��ӦǰA��Ͷ�����Ƭ��Ŀ����_______��
(3)װ��E�е�������____________��
̽�����������ʵ�鷽��ȷ����Ӧ��Ӳ�ʲ�����B�к�ɫ����ijɷ֡�
(4)��Ӳ�ʲ�����B��ȴ��ȡ�������еĹ�����������___��������Һ�ֳ����ݡ�
(5)һ�ݵμӼ���KSCN��Һ������Һ���ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ____ (����ţ���ͬ)������Һδ���ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ______��
��һ����Fe3O4����һ����Fe ��ֻ��Fe3O4������ֻ��Fe
(6)��һ���ý�ͷ�ιܼ���_______(���Լ�������)������֤����Һ�д���Fe2����
̽��������������̲ⶨ��Ӧ��Ӳ�ʲ�����B�й��庬��Ԫ�ص�����������
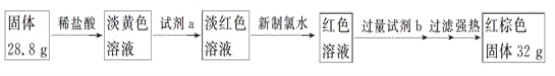
(7)�Լ�b�Ļ�ѧʽ��____________��
(8)���㷴Ӧ��Bװ������Ԫ�ص���������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ������ͼ��Ӱ���ֵ��ǣ� ��
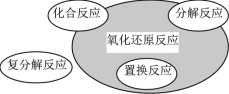
A.CO2��2Mg![]() 2MgO��C
2MgO��C
B.2NaCl��2H2O![]() 2NaOH��Cl2����H2��
2NaOH��Cl2����H2��
C.2NaHCO3![]() Na2CO3��CO2����H2O
Na2CO3��CO2����H2O
D.4Fe(OH)2��O2��2H2O��4Fe(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������V L 0.5 mol��L��1�����ᣬ������Ũ������һ�������·��������˲��õ���(����)
A.����Ũ����ԭ�������һ��B.����5 mol��L��1������0.125V L
C.����10 mol��L��1������0.1V L����ϡ����1.5V LD.�����ͨ��11.2 L�Ȼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֺ��ƻ�������ɵĻ����13.7�ˣ�����ˮ����μ���ijŨ�����ᣬ����CO2���������ɱ�״��������������������ϵ��ͼ��
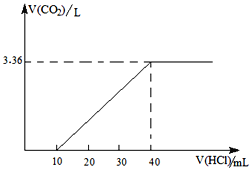
(1)������������ʵ���Ũ��Ϊ________________��
(2)���ֺ��ƻ�����Ļ�ѧʽ������֮��֮��Ϊ_________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com