
| m |
| M |
| 9.6g |
| 64g/mol |
| v |
| vm |
| 2.24L |
| 22.4L/mol |
| n |
| v |
| 0.5mol |
| 0.1L |
| n |
| v |
| 0.1mol |
| 0.1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
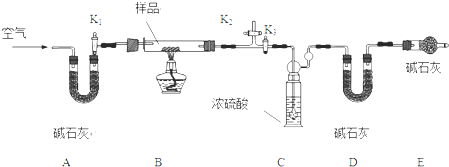
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铝为
| ||
B、C1=
| ||
| C、d=a+17b | ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
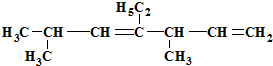 的名称是( )
的名称是( )| A、2,5-二甲基-4-乙基-3,6-庚二烯 |
| B、1,1,4-三甲基-3-乙基-2,5-己二烯 |
| C、3,6-二甲基-4-乙基-1,4-庚二烯 |
| D、2,5-二甲基-4-乙基-3,6-二庚烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2 |
| B、Cu+HNO3(稀)→Cu(NO3)2 |
| C、Cu+空气→CuO CuO+HNO3→Cu(NO3)2 |
| D、Cu+浓硫酸→CuSO4 CuSO4+Ba(NO3)2→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、羧酸与醇在强酸的存在下加热,可得到酯 |
| B、乙酸和甲醇发生酯化反应生成甲酸乙酯 |
| C、酯化反应的逆反应是水解反应 |
| D、果类和花草中存在着有芳香气味的低级酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
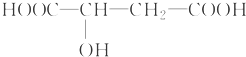 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) |
| D、1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有强氧化性,稀硫酸无氧化性 |
| B、浓硫酸滴到蓝矾上,蓝矾变成白色粉末,体现了浓硫酸的脱水性 |
| C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
| D、浓硫酸与铜的反应中,浓硫酸仅表现强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com