
A、铝为
| ||
B、C1=
| ||
| C、d=a+17b | ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
| b |
| 2 |
| a-9b |
| 6 |
| 12b-a |
| 9 |
| c2V2 |
| V1 |
| bg |
| 2g/mol |
| bg |
| 2g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A、原溶液中一定含有Na2SO4 |
| B、反应后形成的溶液溶质为NaCl |
| C、原溶液中含有CO32-与AlO2-的物质的量比为3:4 |
| D、原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2-,K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
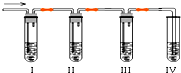 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s12p1表示的是激发态原子的电子排布 |
| B、处于同一轨道上的电子的运动状态完全相同 |
| C、在含4 mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA |
| D、晶体硅、晶体氖均是由相应原子直接构成的原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeC13 |
| B、NaC1 |
| C、KNO3 |
| D、Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| 13 |
| 2 |
| 9 |
| 2 |
| 9 |
| 2 |
| A、△H=-2 878 kJ?mol-1 |
| B、△H=-2 658 kJ?mol- |
| C、△H=-1 746 kJ?mol-1 |
| D、△H=-1 526 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 |
| B、②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/LNaOH溶液,溶液的pH随加入酸体积的变化 |
| C、③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/LH2C2O4溶液混合时,n (Mn2+)随时间的变化 |
| D、④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com