
 能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
| n(CH3OH) |
| n(CO) |
| △c |
| △t |
| 0.2mol/L |
| 5min |
| 0.1 |
| 0.1×0.22 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、都比较稳定,都呈红褐色 |
| B、都有丁达尔现象 |
| C、加入足量盐酸,均可发生化学反应 |
| D、分散质微粒均可透过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A、X是HCl,Y是饱和食盐水 |
| B、X是CO2,Y是稀H2SO4 |
| C、X是SO2,Y是NaOH溶液 |
| D、X是NH3,Y是NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 验室用如图所示的装置制取乙酸乙酯.
验室用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
A、铝为
| ||
B、C1=
| ||
| C、d=a+17b | ||
| D、与金属反应后剩余盐酸为(C1V1-b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
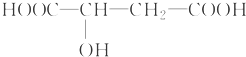 .下列相关说法不正确的是( )
.下列相关说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) |
| D、1 mol苹果酸与Na2CO3溶液反应一定消耗2 mol Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com