碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)
2?yCuCO
3.孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)
2?CuCO
3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol/LCu(NO
3)
2溶液、2.0mL 0.50mol/LNaOH溶液和0.25mol/L
Na
2CO
3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
表Ⅰ表Ⅱ
| 编号 | V (Na2CO3)/mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
(1)实验室制取少许孔雀石,应该采用的最佳反应条件:①Cu(NO
3)
2溶液与Na
2CO
3溶液的体积比为
;②反应温度是
.
(2)80℃时,所制得的孔雀石有少量褐色物质的原因是
.
实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
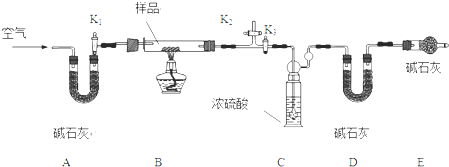
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K
1、K
2,关闭K
3,鼓入空气,一段时间后关闭活塞K
1、K
2,打开K
3,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
(3)步骤4:
.
步骤5:称量相关装置的质量.
(4)装置A的作用是
;若无装置E,则实验测定的x/y的比值将
(选填“偏大”、“偏小”或“无影响”).
(5)某同学在实验过程中采集了如下数据:
a.反应前玻璃管与样品的质量163.8g
b.反应后玻璃管中残留固体质量56.0g
c.装置C实验后增重9.0g
d.装置D实验后增重8.8g
为测定
的比值,你认为可以选用上述所采集数据中的
(写出所有组合的字母代号)一组即可进行计算.
(6)根据你的计算结果,写出该样品组成的化学式
.




 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
 能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
能源是人类生存和发展的重要支柱,碳元素的单质及化合物是人类生产生活的主要能源物质.
 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题: