
| m |
| n |
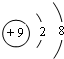 ,
,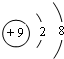 ;同位素
;同位素| 3.01×1024 |
| 6.02×1023 |
| 1 |
| 2 |
| 15.6g |
| 0.2mol |
| 3.6g |
| 20g/mol |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、PCl5为0.6mol |
| B、PCl3大于0.8mol |
| C、再次达平衡时PCl5的体积分数比原平衡减小 |
| D、再次达平衡时PCl5的转化率比原平衡减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积减半,则压强为原来的两倍 |
| B、平衡向右移动,混合气体的颜色一定会变浅 |
| C、体积减半,压强增大,但小于原来的2倍 |
| D、平衡向右移动,混合气体密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
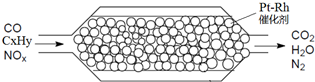
| A、NOX全部被过量CO还原为N2 |
| B、安装有该净化器的汽车可以使用含铅汽油 |
| C、催化剂涂在蜂窝状陶瓷上,可以提高反应速率 |
| D、当产生2.24L氮气时,转移的电子为4xmol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A为SO2和H2的混合物 |
| B、气体A中SO2和H2的体积比为1:5 |
| C、反应中消耗的Zn的质量为97.5 g |
| D、反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2gH2中含氢原子数为 NA |
| B、1L 1mol/L BaCl2溶液中含有的氯离子数为NA |
| C、标准状况下,22.4L H2O所含的原子数为3 NA |
| D、0.1mol铁粉在足量氯气中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15 g乙烷所含极性共价键的数目为3×6.02×1023 |
| B、标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
| C、常温下,100 mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
| D、一定条件下,2 mol 二氧化硫和1 mol 氧气混合,反应时转移的电子数为4×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com