
| A、2gH2中含氢原子数为 NA |
| B、1L 1mol/L BaCl2溶液中含有的氯离子数为NA |
| C、标准状况下,22.4L H2O所含的原子数为3 NA |
| D、0.1mol铁粉在足量氯气中充分燃烧,转移的电子数为0.3NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
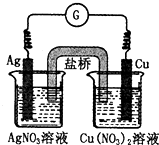 如图所示原电池的总反应为Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s),下列叙述正确的是( )| A、电子从银电极经导线流向铜电极 |
| B、工作一段时间后,右烧杯中溶液的pH变小 |
| C、电池工作时,Cu2+向铜电极移动 |
| D、将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol苯酚中“C=C”的个数为3NA | ||
| B、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | ||
C、标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为
| ||
| D、常温常压下,22.4L丙烷所含有的共价键数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
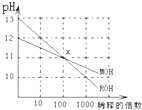
| A、MOH和ROH都是强碱 |
| B、在x点,c(M+)=c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳分子中存在共价键和分子间作用力 |
| B、甲烷、氨和水都是由极性键结合而成的极性分子 |
| C、同主族不同元素的最高价氧化物,一定具有相同的晶体结构 |
| D、氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
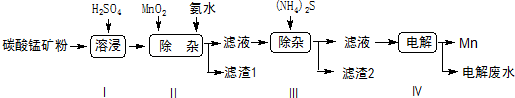
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com