
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )
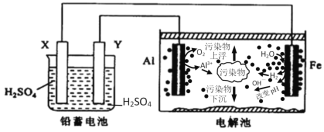
A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
【答案】B
【解析】
据图可知电解池中,铝电极失电子作阳极,电极反应为:2Al-6e-=2Al3+,在铝表面有氧气产生,说明有部分氢氧根离子放电,铁电极上水得电子作阴极,电极反应为:6H2O+6e-=3H2↑+6OH-,铅蓄电池中X与阴极铁相连,作负极,负极上发生的反应是Pb+SO42--2e-=PbSO4,Y与阳极铝相连,作正极,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O,串联电路中各电极转移电子相等,据此分析解答。
A.蓄电池中两电极都生成硫酸铅,因此两个电极的质量都增加,A错误;
B.铝电极失电子作阳极,电极反应为:2Al-6e-=2Al3+,在铝表面有氧气产生,说明有部分氢氧根离子放电,OH-是水电离产生,说明电解池阳极上被氧化的还原剂有Al和H2O,B正确;
C.阳极铝电极反应为:2Al-6e-=2Al3+,阴极铁电极电极反应为6H2O+6e-=3H2↑+6OH-,总反应为2Al+6H2O![]() 2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O
2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O![]() O2↑+2H2↑,C错误;
O2↑+2H2↑,C错误;
D.n(Pb)=![]() =0.5mol,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,D错误;
=0.5mol,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。测定产品的纯度:准确称取1.5g产品放入锥形瓶中,加入
和浓硝酸反应制得。测定产品的纯度:准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为_________。
②滴定终点的现象为____________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的框架,请在表中①~⑩元素中回答问题。
① |
|
| |||||||||||||||
|
|
|
|
| ② | ③ | ④ |
| |||||||||
⑤ | ⑥ | ⑦ |
|
|
| ⑧ |
| ||||||||||
⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ⑩ |
|
请回答下列问题:
(1)元素②的原子结构示意图是___。
(2)在表中④、⑤、⑥三种元素的简单离子半径由小到大的顺序为___(填离子符号)。
(3)其中⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为____。
(4)⑧与⑩两种元素非金属较强的是___(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应aA+bB![]() cC在某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K数值的相应变化为( )
cC在某温度下的平衡常数为K(K≠1),反应热为ΔH。保持温度不变,将方程式的书写作如下改变,则ΔH和K数值的相应变化为( )
A.写成2aA+2bB![]() 2cC,ΔH值、K值均扩大了一倍
2cC,ΔH值、K值均扩大了一倍
B.写成2aA+2bB![]() 2cC,ΔH值扩大了一倍,K值保持不变
2cC,ΔH值扩大了一倍,K值保持不变
C.写成cC![]() aA+bB,ΔH值、K值变为原来的相反数
aA+bB,ΔH值、K值变为原来的相反数
D.写成cC![]() aA+bB,ΔH值变为原来的相反数,K值变为原来的倒数
aA+bB,ΔH值变为原来的相反数,K值变为原来的倒数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙都是二元固体化合物,将32g的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量![]() 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀![]() ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入![]() 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体![]() 。
。
![]() 写出构成甲的阴离子的结构示意图______,32g甲在足量浓硝酸中反应转移的电子数为______。
写出构成甲的阴离子的结构示意图______,32g甲在足量浓硝酸中反应转移的电子数为______。
![]() 乙的化学式______;稀硫酸溶解乙的化学方程式______。
乙的化学式______;稀硫酸溶解乙的化学方程式______。
![]() 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______,设计实验证明此步反应后的溶液中金属元素的化合价______。
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______,设计实验证明此步反应后的溶液中金属元素的化合价______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池是一种新型电池,其能量密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉。已知锂硫电池的总反应为![]() ,用此电池作电源电解足量的
,用此电池作电源电解足量的![]() 溶液,其工作原理如图所示。下列有关说法正确的是( )
溶液,其工作原理如图所示。下列有关说法正确的是( )

A.乙池溶液中的NO3![]() 移向铁电极
移向铁电极
B.乙池石墨电极反应式为![]()
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生![]() 氧气
氧气![]() 标准状况下
标准状况下![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3。下列有关说法正确的是
6C+Li3V2(PO4)3。下列有关说法正确的是
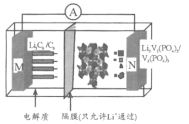
A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com