
【题目】如图是元素周期表的框架,请在表中①~⑩元素中回答问题。
① |
|
| |||||||||||||||
|
|
|
|
| ② | ③ | ④ |
| |||||||||
⑤ | ⑥ | ⑦ |
|
|
| ⑧ |
| ||||||||||
⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ⑩ |
|
请回答下列问题:
(1)元素②的原子结构示意图是___。
(2)在表中④、⑤、⑥三种元素的简单离子半径由小到大的顺序为___(填离子符号)。
(3)其中⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为____。
(4)⑧与⑩两种元素非金属较强的是___(填元素符号)。
【答案】![]() F->Na+>Mg2+ Al2O3+2OH- ==2AlO2-+H2O Cl
F->Na+>Mg2+ Al2O3+2OH- ==2AlO2-+H2O Cl
【解析】
根据元素周期表结构可知,①为H,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为Cl,⑨为K,⑩为Br,同周期从左向右金属性逐渐减弱,非金属性逐渐增强,原子半径逐渐减小,同主族从上到下金属性逐渐增强,非金属性逐渐减弱,原子半径逐渐增大,据此分析解答。
(1)元素②为N,为7号元素,原子结构示意图为:![]() ;
;
(2)④、⑤、⑥三种元素的简单离子分别为F-、Na+、Mg2+,核外电子排布相同,核电荷数越大,离子半径越小,因此离子半径F->Na+>Mg2+;
(3)⑤的最高价氧化物的水化物为NaOH,⑦的最高价氧化物为Al2O3,二者反应生成NaAlO2,离子方程式为:Al2O3+2OH- ==2AlO2-+H2O;
(4)⑧与⑩分别为Cl和Br,同主族从上到下非金属性逐渐减弱,因此两种元素中非金属性较强的是Cl。
金属性比较 | 本质 | 原子越易失电子,金属性越强(与原子失电子数目无关) |
判断方法 | ①在金属活动性顺序表中越靠前,金属性越强 | |
②单质与水或非氧化性酸反应越剧烈,金属性越强 | ||
③单质还原性越强或阳离子氧化性越弱,金属性越强 | ||
④最高价氧化物对应水化物的碱性越强,金属性越强 | ||
⑤若Xn++Y―→X+Ym+,则Y比X的金属性强 | ||
⑥元素在周期表中的位置:左边或下方元素的金属性强 | ||
非金属性比较 | 本质 | 原子越易得电子,非金属性越强(与原子得电子数目无关) |
判断方法 | ①与H2化合越容易,气态氢化物越稳定,非金属性越强 | |
②单质氧化性越强或阴离子还原性越弱,非金属性越强 | ||
③最高价氧化物对应水化物的酸性越强,非金属性越强 | ||
④元素在周期表中的位置:右边或上方元素的非金属性强 |


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有![]() 和少量的
和少量的![]() 、
、![]() 。以石棉尾矿为镁源制备碳酸镁晶体
。以石棉尾矿为镁源制备碳酸镁晶体![]() 的工艺如图:
的工艺如图:

“调节pH除杂”时,需将pH调至![]() ,则除去的杂质离子是______,此时溶液中的
,则除去的杂质离子是______,此时溶液中的![]() ______
______![]() 已知
已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体PCl5受热即挥发并发生分解:PCl5(g)![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示。
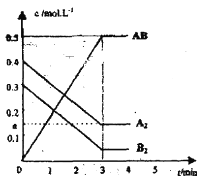
(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。____
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应开始时v正____v逆 (填“>”、“<”或“=”)。判断依据是____________________________________________________。反应达到平衡后,各物质的体积分数与原平衡相比____(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)如何判断滴定达到终点__________________________ 。
(2)该小组在步骤①中的错误是_________________ ,由此造成的测定结果_____________(填偏高、偏低或无影响);
(3)步骤②缺少的操作是__________________________;
(4)如图,是某次滴定时滴定管中的液面,其读数为_____________ mL

(5)根据下列数据:
滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
滴定前读(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.80 | 23.10 |
请选用合理的数据计算待测烧碱溶液的浓度为_____________ mol/L(保留到小数点后四位)
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定前读数正确,滴定结束时俯视读数:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式_______________________。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是_________________。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是__________________________________。
(5)若A是一种溶液,只可能含有![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )
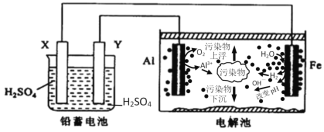
A.X电极质量减轻,Y电极质量增加
B.电解池阳极上被氧化的还原剂有Al和H2O
C.电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.每消耗103.5gPb,理论上电解池阴极上有1molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
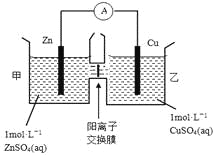
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com