
【题目】某同学进行实验研究时,需要配制450mL 0.1 mol·L-1 Na2CO3溶液。
(1)经过计算,使用托盘天平应该称量__________g Na2CO3固体;
(2)配制溶液时,除了托盘天平、药匙 、量筒、烧杯、玻璃棒外,还需要的仪器有______________________________________________________;
(3)配制溶液时,需经过称量、溶解、转移溶液、_________、定容、摇匀等操作。下列图示对应的操作规范的一个是____________;


![]()
![]()
A.称量 B.溶解 C.转移 D.定容
(4)误差分析:若配制溶液时,洗干净的容量瓶中残留有少量蒸馏水,则所配溶液的浓度____________;若摇匀后发现液面低于刻度线,又加入少量蒸馏水与刻度线相平,则所配溶液的浓度_________________。(填偏高、偏低、无影响)
【答案】 5.3g 500mL容量瓶、 胶头滴管 洗液(洗涤) B 无影响 偏低
【解析】(1)应该用500mL容量瓶,则使用托盘天平应该称量0.5L×0.1mol/L×106g/mol=5.3g Na2CO3固体;(2)配制溶液时,除了托盘天平、药匙、量筒、烧杯、玻璃棒外,还需要的仪器有500mL容量瓶、胶头滴管(定容时需要);(3)配制溶液时,需经过称量、溶解、冷却、转移溶液、洗涤、振荡、定容、摇匀等操作。A.称量时应该左物右码,A错误;B.溶解在烧杯中进行,用玻璃棒搅拌,B正确;C.转移需要玻璃棒引流,C错误;D.定容时胶头滴管不能插入容量瓶中,D错误,答案选B。(4)若配制溶液时,洗干净的容量瓶中残留有少量蒸馏水,则所配溶液的浓度无影响;若摇匀后发现液面低于刻度线,又加入少量蒸馏水与刻度线相平,导致溶液体积增加,则所配溶液的浓度偏低。


科目:高中化学 来源: 题型:
【题目】在25℃时,物质的浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中NH的物质的量浓度分别为a、b、c(单位为mol·L-1),下列判断正确的是
A.a=b=cB.a=c>bC.b>a>cD.c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2能与CO2反应生成氧气,在潜水艇中用作制氧剂。某学生以足量的大理石、足量的盐酸和Na2O2样品为原料,验证Na2O2能与CO2反应生成O2,设计出如下实验装置:

(1)装置B中发生的离子反应方程式是___________________________;
(2)装置D的化学反应方程式是_________________________________;
(3)若E中的石灰水出现轻微白色浑浊,原因可能是___________________________;
(4)如何验证Na2O2能与CO2反应生成O2:____________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生22.4L气体
C. 若实验室需要4.6mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g) +nB(g)![]() cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) △H的影响,以A和B物质的量之比为 m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )

A. 在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大
B. 升高温度,正、逆反应速率都增大,平衡常数增大
C. △H <0 m + n > c
D. △H >0 m +n < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是
A. 漂白粉的有效成分是氯化钠 B. 氯水中的次氯酸具有杀菌消毒作用
C. 晶体硅是制造半导体的常用材料 D. 石英的主要成分是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2![]() LiNH2+LiH。下列有关说法正确的是( )
LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等 D. 此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.10 mol/L、体积均为![]() 的HA和HB溶液,分别加水稀释至体积V,PH随
的HA和HB溶液,分别加水稀释至体积V,PH随![]() 的变化如图所示,下列叙述正确的是( )
的变化如图所示,下列叙述正确的是( )

A. 该温度下HB的电离平衡常数约等于1.11×10-5
B. 当![]() =3时,若两溶液同时升高温度,则c(B)/c(A)减小
=3时,若两溶液同时升高温度,则c(B)/c(A)减小
C. 相同条件下NaA溶液的pH大于NaB溶液的pH
D. 溶液中水的电离程度:a = c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
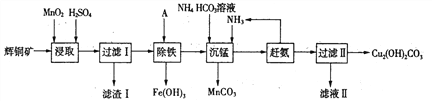
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
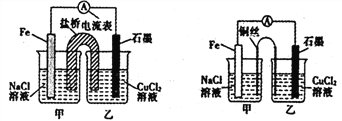
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com