
【题目】(化学——选修3: 物质结构与性质)
我国考古人员在秦陵挖掘的宝剑,到现在仍然锋利无比,原因是剑锋上覆盖了一层铬。铬能形成多种化合物,主要化合价有+2价、+3价、+6价。
请回答下列问题:
(1)基态铬原子的外围电子排布式为 ________;与铬同周期的所有元素中,基态原子最高能层电子数与铬原子未成对电子数相同的元素是 ________。
(2)铬原子的各级电离能(I:kJ·mol-1)数据如下表所示,铬原子逐级电离能增大的原因是 ________。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(3)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种暗绿色固体与足量硝酸银反应时,1mol 固体可生成1mol氯化银沉淀。则这种暗绿色固体的化学式为 ________,其中铬的配体水分子的VSEPR模型为 ________,该配合物中存在的作用力有 ________ (填标号)。
A.离子键 B.配位键 C.共价键 D.金属键
(4)CrO3能将乙醇氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是 ________。
(5)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示:

①该晶体的化学式为 ________。
②该晶体中距离镧原子最近的铬原子有 ________个;若两个距离最近的氧原子核间距为a pm,组成物质的摩尔质量为b g·mol-1,阿伏加德罗常数值为NA,则晶体密度的表达式为 ______ g·cm-3。
【答案】3d54s1 Se或硒 随着电子的逐个失去,阳离子所带正电荷数越来越大,再失一个电子需要克服的电性引力也越来越大,消耗的能量也越来越多 [CrCl2(H2O)4]Cl 2H2O或[Cr (H2O)4 Cl2]Cl 2H2O 四面体形 ABC 乙醇能形成分子间氢键 LaCrO3 8 ![]()
【解析】
(1)铬元素原子的原子序数为24,其原子核外有24个电子,3d能级上有4个电子、4s能级上有2个电子,3d、4s电子为其价电子;其外围电子排布式根据泡利原理与洪特规则即能量最低原理作答;其未成对电子数根据外围电子排布式得出,再结合铬位于元素周期表的第四周期,最高能层为N层分析作答。
(2)电离能,是指将气态原子内的电子离开原子所需要的能量;越靠近原子核,原子核对电子的吸引力越大,需要的能量就越大,据此分析;
(3)1 mol固体可生成1 mol氯化银沉淀,说明该配合物的分子的外界有1个氯离子,结合配位数是6,其元素原子守恒思想分析作答;依据价层电子对互斥理论分析水分子的VSEPR模型;结合配合物的化学键构成得出结论;
(4)氢键的存在导致物质的熔沸点升高;
(5)①根据均摊法计算晶胞中La、Cr、O原子数目,进而确定化学式;
②一个镧原子为八个晶胞共用,一个铬原子为一个晶胞所用,则可得知距离镧原子最近的铬原子的个数;两个距离最近的氧原子核间距与正方体的边长构成等腰直角三角形,得出正方体的边长为![]() a,再结合晶体密度 =
a,再结合晶体密度 = ![]() 公式分析作答。
公式分析作答。
(1)铬元素原子的原子序数为24,位于元素周期表的第四周期VIB族,其基态铬原子的外围电子排布式为3d54s1,,其未成对电子数为6,与铬处于同周期的所有元素中,基态原子最高能层电子数为6的原子外围电子排布式为4s24p4,即该元素为Se或硒,
故答案为:3d54s1;Se或硒;
(2)对于同一种元素来说,随着电子的逐个失去,阳离子所带正电荷数越来越大,再失一个电子需要克服的电性引力也越来越大,消耗的能量也越来越多,导致其逐级电离能会越来越大,
故答案为:随着电子的逐个失去,阳离子所带正电荷数越来越大,再失一个电子需要克服的电性引力也越来越大,消耗的能量也越来越多;
(3)1 mol固体可生成1 mol氯化银沉淀,说明该配合物分子的外界有1个氯离子,又因为该配合物的配位数是6,根据氯原子守恒知,则该配合物内界中含有1个氯原子和5个水分子,其余水分子以结晶水形式存在,其化学式为[CrCl2(H2O)4]Cl 2H2O或[Cr (H2O)4 Cl2]Cl 2H2O;根据价层电子对互斥理论可知,水分子的中心原子为O,其孤电子对数为2,σ键电子对数为2,故中心原子的价电子数为2+2 = 4 ,其VSEPR模型为四面体形,该配合物外界存在氯离子,与配位体形成离子键,而配合物内界的中心离子铬离子与氯离子、水分子之间均存在配位键,其中水分子内部H与O原子之间存在共价键,故ABC正确,而金属键是金属离子与自由电子之间的一种化学键,主要存在于金属金体之间,故D项错误,
故答案为:[CrCl2(H2O)4]Cl 2H2O或[Cr(H2O)4Cl2]Cl 2H2O;四面体形;ABC;
(4)乙醇分子之间能形成氢键,而乙醛分子之间不能形成氢键,氢键的存在导致乙醇熔沸点大于乙醛,
故答案为:乙醇能形成分子间氢键;
(5)①晶胞中La原子位于立方体的顶点上,其原子数目= 8×![]() = 1,Cr原子为立方体的中心,其原子数目 = 1、O原子位于立方体的体面上,其原子数目= 6×
= 1,Cr原子为立方体的中心,其原子数目 = 1、O原子位于立方体的体面上,其原子数目= 6×![]() =3,该晶体的化学式为:LaCrO3,
=3,该晶体的化学式为:LaCrO3,
故答案为:LaCrO3;
②结合该晶体的结构可看出,一个镧原子为八个晶胞共用,一个铬原子为一个晶胞所用,则距离镧原子最近的铬原子有8个;两个距离最近的氧原子核间距与正方体的边长构成等腰直角三角形,设则正方体的边长为x pm,根据几何关系式可知,(![]() )2 + (
)2 + (![]() )2 = a2,则x =
)2 = a2,则x =![]() a pm, 因此该晶胞体积为(
a pm, 因此该晶胞体积为(![]() a×10-10 pm)3,又知一个晶胞的质量为
a×10-10 pm)3,又知一个晶胞的质量为![]() =
= ![]() g,故其密度 =
g,故其密度 =  =
= ![]() g·cm-3,
g·cm-3,
故答案为:8;![]() ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法中正确的是
A. 4g甲烷完全燃烧转移的电子数为2NA
B. 11.2L(标准状况)CCl4中含有的共价键数为2NA
C. 3 mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. 1L 0.1mol·L-1的Na2S溶液中HS-和S2-离子数之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 Urolithin A常用于合成某药物,其结构简式如图所示。下列说法错误的是
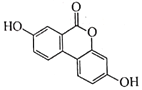
A. Urolithin A分于中苯环上的一氯代物有6种
B. Urolithin A分子中所有原子不可能共平面
C. Urolithin A能发生加成、取代和氧化反应
D. Urolithin A在稀硫酸中的水解产物含2种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。

(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<![]()
B. 浓度为0.1mol·L-1的 NaHCO3溶液:c(H2CO3)>c(CO32-)
C. 25℃时,AgCl固体在等物质的量浓度的NaC1、CaCl2溶液中溶度积相同
D. 冰醋酸中逐滴加水,溶液的导电性、醋酸电离程度、pH均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”ke牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中c(H+)/c(CH3COOH)值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa 固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________________;该混合溶液中:c(A-)-c(Na+)= ________________mol/L(填准确数值)
(3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa
①三种溶液pH由大到小的顺序为:_______________(填序号)
②溶液a的pH大于8,则溶液中c(H2CO3)___ c(CO32―)(填“>” “<”或“=”)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com