


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
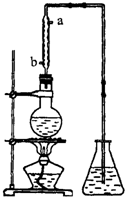 久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:
久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O |
| B、3Cl2+6KOH═5KCl+KClO3+3H2O |
| C、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| D、CuCl2+Ba(OH)2═Cu(OH)3↓+BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
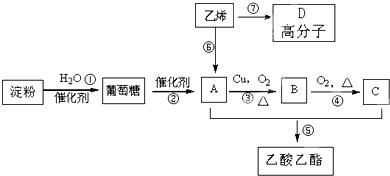
查看答案和解析>>
科目:高中化学 来源: 题型:
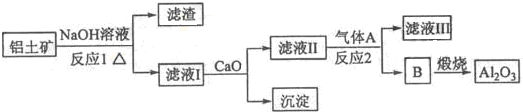
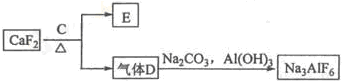
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | ||
B、
| ||
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com