
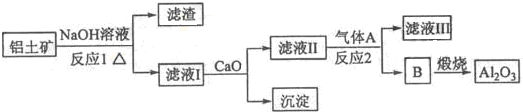
| ||
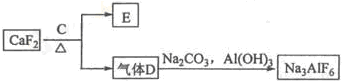
| 冰晶石 |
| ||
| 冰晶石 |


科目:高中化学 来源: 题型:
| A、0.03mol/L |
| B、0.3mol/L |
| C、0.05mol/L |
| D、0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
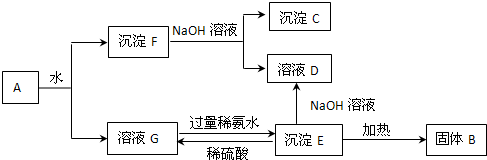
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于燃烧均为放热反应,所以石墨为重要的能源 |
| B、由于燃烧反应放热,所以△H1和△H2均取正值 |
| C、由于石墨和金刚石同为碳元素组成,所以△H1=△H2 |
| D、由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
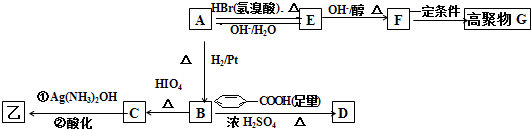
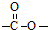 结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:| △ |
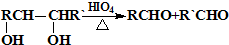
查看答案和解析>>
科目:高中化学 来源: 题型:
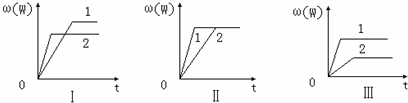
| A、图Ⅰ可能是不同压强对反应的影响,且P2>P1,a>n |
| B、图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好 |
| C、图Ⅱ可能是不同压强对反应的影响,且P1>P2,n=a+b |
| D、图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
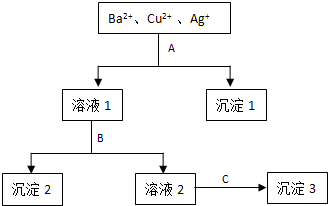
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Mg2+、ClO-、Cl-能大量共存 | ||
| B、滴入酚酞试液显红色的溶液中:K+、Na+、NO3-、SO42- | ||
C、含大量K+、Na+、NO3-、CO32-的溶液中c(H+)=
| ||
| D、C(Fe3+)=0.1 mol/L的溶液中:NH4+、Al3+、I-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com