
| A、Fe2+、Mg2+、ClO-、Cl-能大量共存 | ||
| B、滴入酚酞试液显红色的溶液中:K+、Na+、NO3-、SO42- | ||
C、含大量K+、Na+、NO3-、CO32-的溶液中c(H+)=
| ||
| D、C(Fe3+)=0.1 mol/L的溶液中:NH4+、Al3+、I-、SO42- |
| Kw |
| Kw |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
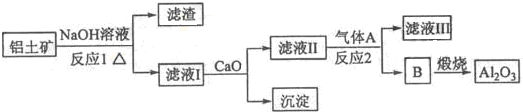
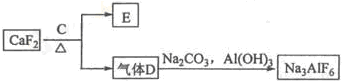
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | ||
B、
| ||
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
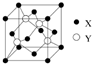 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:
 地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.
地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:
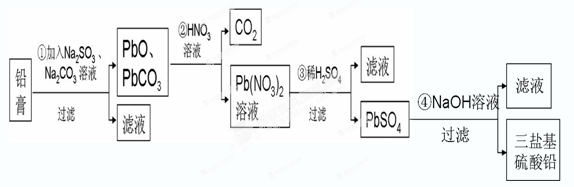
查看答案和解析>>
科目:高中化学 来源: 题型:
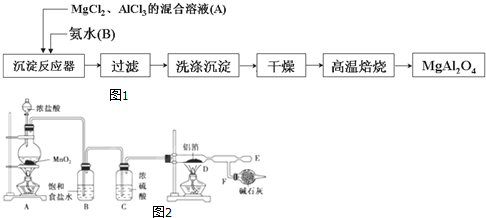
查看答案和解析>>
科目:高中化学 来源: 题型:
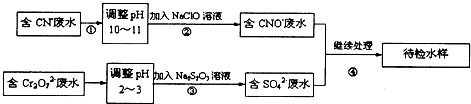
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com