
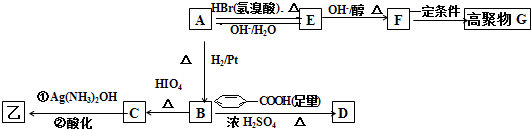
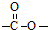 结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:| △ |
| 3n-x |
| 2 |
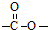 结构的基团,B只生成C,根据题给信息知,B为CH3CH(OH)CH(OH)CH3,A为CH3COCH(OH)CH3,在浓硫酸作催化剂、加热条件下,CH3CH(OH)CH(OH)CH3和苯甲酸发生酯化反应生成D,则D的结构简式为:
结构的基团,B只生成C,根据题给信息知,B为CH3CH(OH)CH(OH)CH3,A为CH3COCH(OH)CH3,在浓硫酸作催化剂、加热条件下,CH3CH(OH)CH(OH)CH3和苯甲酸发生酯化反应生成D,则D的结构简式为: ,A和氢溴酸发生取代反应生成E,则E的结构简式为:CH3COCH(Br)CH3,E和氢氧化钠的醇溶液发生消去反应生成F,则F的结构简式为:CH3COCH=CH2,F在一定条件下发生加聚反应生成G,则G的结构简式为:
,A和氢溴酸发生取代反应生成E,则E的结构简式为:CH3COCH(Br)CH3,E和氢氧化钠的醇溶液发生消去反应生成F,则F的结构简式为:CH3COCH=CH2,F在一定条件下发生加聚反应生成G,则G的结构简式为: .
.| 3n-x |
| 2 |
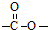 结构的基团,B只生成C,根据题给信息知,B为CH3CH(OH)CH(OH)CH3,A为CH3COCH(OH)CH3,在浓硫酸作催化剂、加热条件下,CH3CH(OH)CH(OH)CH3和苯甲酸发生酯化反应生成D,则D的结构简式为:
结构的基团,B只生成C,根据题给信息知,B为CH3CH(OH)CH(OH)CH3,A为CH3COCH(OH)CH3,在浓硫酸作催化剂、加热条件下,CH3CH(OH)CH(OH)CH3和苯甲酸发生酯化反应生成D,则D的结构简式为: ,A和氢溴酸发生取代反应生成E,则E的结构简式为:CH3COCH(Br)CH3,E和氢氧化钠的醇溶液发生消去反应生成F,则F的结构简式为:CH3COCH=CH2,F在一定条件下发生加聚反应生成G,则G的结构简式为:
,A和氢溴酸发生取代反应生成E,则E的结构简式为:CH3COCH(Br)CH3,E和氢氧化钠的醇溶液发生消去反应生成F,则F的结构简式为:CH3COCH=CH2,F在一定条件下发生加聚反应生成G,则G的结构简式为:
 ,
, ;
; ,
, ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O |
| B、3Cl2+6KOH═5KCl+KClO3+3H2O |
| C、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| D、CuCl2+Ba(OH)2═Cu(OH)3↓+BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
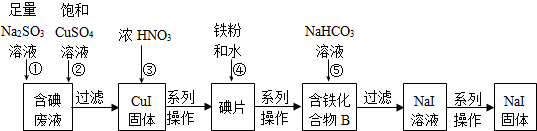
查看答案和解析>>
科目:高中化学 来源: 题型:
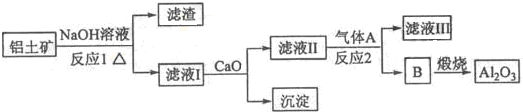
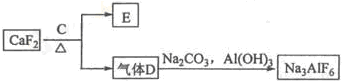
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
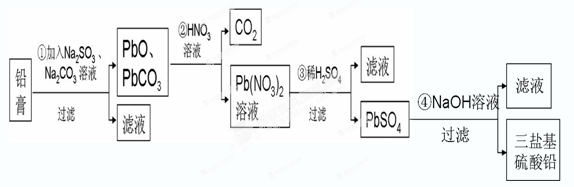
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com