
【题目】某成年人日常生活中,常常伴有溃疡、牙佩出血、牙齿松动、关节痛等症状,原因是缺乏 ( )
A.水B.无机盐C.维生素CD.蛋白质
科目:高中化学 来源: 题型:
【题目】为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:
2H2(g)+CO(g)![]() CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
t/s | 0 | 500 | 1 000 |
c(H2)/(mol·L-1) | 5.00 | 3.52 | 2.48 |
c(CO)/(mol·L-1) | 2.50 |
(1)在500 s内用H2表示的化学反应速率是 。
(2)在1 000 s内用CO表示的化学反应速率是 ,1 000 s时CO的转化率是 。
(3)在500 s时生成的甲醇的浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中属于有机物的是( )
①乙醇 ②蛋白质 ③石墨 ④甲烷 ⑤蔗糖 ⑥碳酸 ⑦一氧化碳 ⑧碳酸钙 ⑨乙酸
A.①④⑤⑦⑧⑨B.①④⑤⑨C.①②④⑤⑨D.①②④ ⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢两种元素组成,其中含碳的质量分数为85.7%,在标准状况下11.2L此化合物的质量为14g,求此化合物的分子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | NaOH固体、浓氨水 | NH3 | |
Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
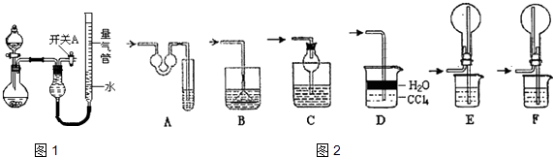
(1)实验过程中,使用分液漏斗滴加液体的操作是 .
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?(填“可行”或“不可行”).原因为
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是 .
(4)实验Ⅱ中量气管中的液体最好是(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.如图2,以下各种尾气吸收装置中,适合于吸收NH3 , 而且能防止倒吸的有 .
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② , ③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积已换算成标准状况,忽略滴入液体体积对气体体积的影响)
编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 346.3mL |
② | 1.0g | 10.0mL | 335.0mL |
③ | 1.0g | 10.0mL | 345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为 . (H:1 Mg:24 Al:27)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列说法正确的是
A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化
B.钢铁生锈腐蚀时,铁被氧化
C.放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生
(2)在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为 。
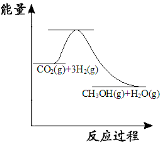
(3)目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g);如图表示该反应进行过程中能量的变化。(单位为:kJ·mol1)该反应是 (填“吸热”或“放热”)反应,ΔH 0(填“>”或“<”)。
CH3OH(g) +H2O(g);如图表示该反应进行过程中能量的变化。(单位为:kJ·mol1)该反应是 (填“吸热”或“放热”)反应,ΔH 0(填“>”或“<”)。
(4)比较下面各组热化学方程式,ΔH1<ΔH2的是 。
A.2H2(g) + O2(g) ![]() 2H2O(g) ΔH1 2H2(g) + O2(g)
2H2O(g) ΔH1 2H2(g) + O2(g) ![]() 2H2O(1) ΔH2
2H2O(1) ΔH2
B.S(g) + O2(g) ![]() SO2(g ) ΔH1 S(s) + O2(g)
SO2(g ) ΔH1 S(s) + O2(g) ![]() SO2(g ) ΔH2
SO2(g ) ΔH2
C.C(s) +![]() O2(g)
O2(g) ![]() CO (g ) ΔH1 C(s) +O2(g)
CO (g ) ΔH1 C(s) +O2(g) ![]() CO2 (g ) ΔH2
CO2 (g ) ΔH2
D.H2(g) + Cl2(g) ![]() 2HCl(g ) ΔH1
2HCl(g ) ΔH1 ![]() H2(g) +
H2(g) +![]() Cl2(g)
Cl2(g) ![]() HCl(g) ΔH2
HCl(g) ΔH2
(5)101 kPa条件下,14 g N2和3 g H2反应生成NH3的能量变化如图示意:
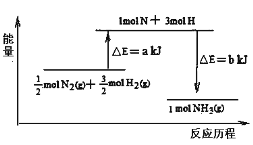
又已知:①已知b=1173;②25℃、101 kPa下N2(g)+3H2 (g) ![]() 2 NH3 (g) ΔH =-92 kJ·mol1,则a = 。
2 NH3 (g) ΔH =-92 kJ·mol1,则a = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示: 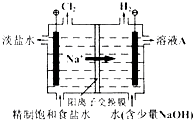
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用平衡移动移动原理解释盐酸的作用:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com