
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )

A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
【答案】D
【解析】
A.两个相连的苯环中,处于对角线位置的5个碳原子共线,再加上碳碳三键的2个碳原子,共7个碳原子一定共直线,A项错误;
B.给苯环上有氢的碳原子编号如下: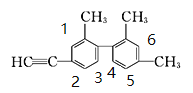 ,因两个苯环无对称性可言,所以该烃苯环上的二氯代物共有15种:1,2、1,3、1,4、1,5、1,6;2,3、2,4、2,5、2,6;3,4、3,5,3,6;4,5,4,6;5,6;
,因两个苯环无对称性可言,所以该烃苯环上的二氯代物共有15种:1,2、1,3、1,4、1,5、1,6;2,3、2,4、2,5、2,6;3,4、3,5,3,6;4,5,4,6;5,6;
C. 该烃的没有对称性,其中苯环上的氢有6种,三个甲基上氢算3种,还有碳碳三键的端点还有一个氢,所以共有9种氢,所以其一氯代物为9种;
D.据A 项分析,已有7个碳原子共线,这条线必在左侧苯环确定的平面内,且苯环上的其余的4个碳和相连的那个甲基的碳原子,共12个碳原子一定共平面,D项正确;
所以答案选D项。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】室温下,一个密闭容器,中间有一个可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入空气,右边充入H2和O2的混合气体,隔板恰好处于容器中间位置,将H2、O2的混合气体点燃引爆,活塞先左弹,恢复至室温后,隔板停在如图位置。则原来H2、O2的物质的量之比可能为

①4:1 ② 2:1 ③1:1 ④2:3
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
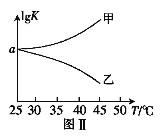
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成
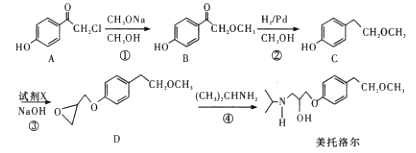
请回答下列问题:
(1)美托洛尔分子中的含氧官能团为______(填名称)。
(2)反应③中加入的试剂X的分子式为C3H5 OCl,X的结构简式为______。
(3)在上述①②③三步反应中,属于取代反应的是______(填序号)。
(4)B的同分异构体满足下列条件
Ⅰ.能发生银镜反应
II.能与FeCl3溶液发生显色反应
Ⅲ.分子中有4种不同化学环境的氢,且1mol该物质与足量金属钠反应产生1molH2,写出其中一种满足上述条件的同分异构体的结构简式:_________
(5)根据已有知识并结合题目所给相关信息,写出以CH3OH和 为有机原料及必要的无机试剂制备
为有机原料及必要的无机试剂制备 的合成路线流程图_______。
的合成路线流程图_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)![]() CO2(g)+N2(g) △H。几种物质的相对能量如下:
CO2(g)+N2(g) △H。几种物质的相对能量如下:

①△H=___________ kJ·mol-1。改变下列“量”,一定会引起△H发生变化的是___________(填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:Fe++N2O===FeO++N2;第二步:____________(写化学方程式)。
第二步步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率_____第一步反应速率(填“大于”或“等于”)。
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g)![]() 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是________。
②在此温度下,该可逆反应的平衡常数K=___________(用含x的代数式表示)。

(3)工业上,利用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和 n molH2,在250℃发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________。
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________。
(4)有人提出,利用2CO(g)===2C(s)+O2(g)消除CO对环境的污染,你的评价是___________(填“可行”或“不可行”)
(5)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
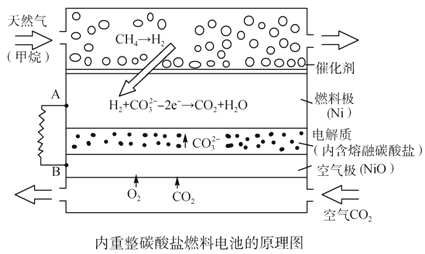
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
I.甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 _____________________________。
II.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度______(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则______(填“甲”或“乙”)判断正确,试剂X是______(填字母序号)。
A.Ba(OH) 2溶液B.BaCl2溶液C.NaOH溶液D.澄清石灰水。
(2)将加热后的溶液冷却到10℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则______(填“甲”或“乙”)判断正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com