
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
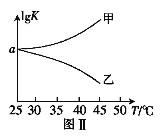
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】2a-b ![]() < 加入催化剂 增大 乙 2 >
< 加入催化剂 增大 乙 2 > ![]() (MPa)-2
(MPa)-2
【解析】
(1)根据盖斯定律将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的;由图Ⅰ虚线知:化学反应速率加快,但平衡不移动,判断改变的条件;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,根据平衡的移动对物质的量的影响,分析判断平均相对分子质量的变化;根据反应③的平衡常数的对数值(lgK)与温度的变化关系图,由于△H3<0,因此升高温度,平衡逆向移动,结合K的变化分析判断正确的曲线;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x,根据三段式计算出25℃时的平衡常数K,再计算lgK,确定a值;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,根据Qc与K的相对大小,判断反应进行的方向,确定v正与v逆的大小;
(3)依据三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算。
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),该反应△H3=2△H1-△H2=2a-b,则平衡常数K3= ![]() ,故答案为:2a-b;
,故答案为:2a-b;![]() ;
;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随着反应的进行,温度逐渐升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变△H<0;根据图Ⅰ虚线知:化学反应速率加快,但平衡不移动,因此改变的条件为加入催化剂;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生上述反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,平衡正向进行,气体物质的量减小,气体质量不变,则混合气体的平均相对分子质量将增大;反应③2NO(g)+Cl2(g)![]() 2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NO(g)+Cl2(g)2NOCl(g)
起始量(mol/L) 0.08 0.04 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.08-2x0.04-x 2x
(0.08-2x+0.04-x+2x):(0.08+0.04)=5:6,解得:x=0.02mol,平衡常数K3= 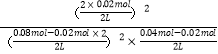 =100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc=
=100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc=![]() =1.4<K=100,反应向正反应方向进行,v
=1.4<K=100,反应向正反应方向进行,v
(3)若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1∶3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.5 1.5 0.5 0.5
平衡量(mol) 0.51.5 0.5 0.5
分压=总压×物质的量分数,则P(CO2)=8× ![]() =
= ![]() ,P(H2)=8×
,P(H2)=8×![]() =4,P(CH3OH)=8×
=4,P(CH3OH)=8×![]() =
= ![]() ,P(H2O)=8×
,P(H2O)=8×![]() =
= ![]() ,Kp=
,Kp= ![]() =
=![]() (MPa)-2,故答案为:
(MPa)-2,故答案为:![]() (MPa)-2。
(MPa)-2。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LHF含分子数目为0.1NA
B. 120 g NaHSO4固体含有H+的数目为NA
C. 100mL0.1mol/L的Na2CO3溶液中,含阴离子的数目大于0.01NA
D. 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、0.5 mol![]() 盐酸、0.55 mol
盐酸、0.55 mol![]() NaOH溶液,实验尚缺少的玻璃用品是________________。
NaOH溶液,实验尚缺少的玻璃用品是________________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____________(填“能”或“否”)
(3)他们记录的实验数据如下:

已知:Q=cm(t2﹣t1),反应后溶液的比热容c为4.18 J℃﹣1g﹣1,
各物质的密度均为1 gcm﹣3。
①计算完成上表ΔH=_____________________________(保留2位小数)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。
(4)若用醋酸代替HCl做实验,对测定结果___填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水的化学反应方程式如下:2NaCl + 2H2O = 2NaOH + Cl2↑+ H2↑,现电解消耗NaCl的质量为175.5g,则
(1)消耗的NaCl的物质的量是多少?______________
(2)生成的Cl2在标准状况下的体积为多少升?______________
(3)生成的H2的质量是多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:P4(s)+6Cl2(g)![]() 4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)
4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)![]() 4PCl5(g) ΔH=bkJ·mol-1;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为___________________。
4PCl5(g) ΔH=bkJ·mol-1;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为___________________。
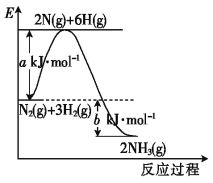
(2)工业合成氨时,合成塔中每生成1molNH3放出46kJ的热量。其反应过程的能量变化如图。b值为________kJ。加入催化剂,a值____(填“增大”“减小”或“不变”,下同)。压缩容器体积,b值___。
(3)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼燃烧产物只有CO2(g)、H2O(g)、N2(g),并放出大量热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是___________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品

①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(______)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
(4)设计实验检验环己烯精品中是否含己二醛_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边CO和CO2分子数之比为1:3
B.右边CO的质量为42g
C.右边气体密度是相同条件下氧气密度的2倍
D.若改变右边CO和CO2的充入量而使隔板处于距离右端![]() 处,若保持温度不变,则前后两次容器内的压强之比为5:6
处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )

A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________
(2)该氢氧化钠溶液浓度为______________
(3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com