
【题目】在 25mL 的氢氧化钠溶液中逐滴加入 0.2 mol/ L 醋酸溶液,滴定曲线如图所示。

(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________
(2)该氢氧化钠溶液浓度为______________
(3)在B点,a____12.5mL(填“>”“<”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合恰好中性,则混合前c(NaOH)____c(CH3COOH),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____c(OH-)(填“>”“<”或“=”)。
【答案】CH3COOH+OH-=CH3COO-+H2O 0.1 > < <
【解析】
(1)离子方程式书写时应注意醋酸和水均为弱电解质,写成分子式的形式;
(2)观察图像可知,滴定之前氢氧化钠溶液的pH,进而可以计算氢氧化钠的浓度;
(3)CH3COONa是强碱弱酸盐,醋酸根离子会水解,CH3COO-+H2O ![]() CH3COOH+OH-,据此解题。
CH3COOH+OH-,据此解题。
(1)氢氧化钠与醋酸钠为可溶性强电解质,可拆成离子形式,醋酸与水为弱电解质,应写成化学式形式,所以氢氧化钠溶液与醋酸溶液反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O;
(2)滴定开始之前,溶液pH=13,c(OH-)=c(NaOH)=0.1mol/L;
(3)在B点,pH=7,因为生成的CH3COONa是强碱弱酸盐,所以此时醋酸过量,即a>12.5mL;由体积相等的NaOH和CH3COOH溶液混合,若浓度相同,则溶液显碱性,现混合溶液呈中性,则酸的浓度大,即c(NaOH)<c(CH3COOH);混合前碱完全电离,而酸不能完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)<c(OH-)。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
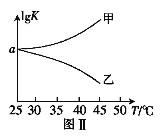
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)![]() CO2(g)+N2(g) △H。几种物质的相对能量如下:
CO2(g)+N2(g) △H。几种物质的相对能量如下:

①△H=___________ kJ·mol-1。改变下列“量”,一定会引起△H发生变化的是___________(填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:Fe++N2O===FeO++N2;第二步:____________(写化学方程式)。
第二步步反应不影响总反应达到平衡所用时间,由此推知,第二步反应速率_____第一步反应速率(填“大于”或“等于”)。
(2)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g)![]() 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是________。
②在此温度下,该可逆反应的平衡常数K=___________(用含x的代数式表示)。

(3)工业上,利用CO和H2合成CH3OH。在1L恒容密闭容器中充入1 mol CO(g)和 n molH2,在250℃发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________。
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________。
(4)有人提出,利用2CO(g)===2C(s)+O2(g)消除CO对环境的污染,你的评价是___________(填“可行”或“不可行”)
(5)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
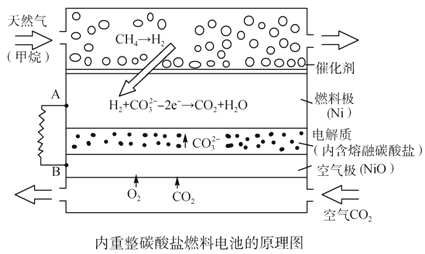
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4—+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
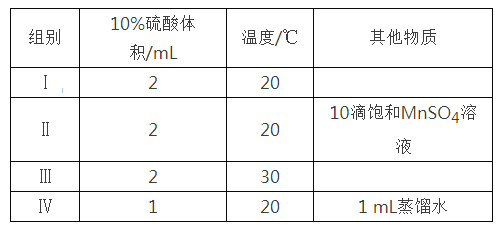
(1)写出该反应的离子方程式______________________,该反应中每生成1molCO2 转移电子数为________ 。
(2)如果研究催化剂对化学反应速率的影响,使用实验_______和________(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验________和_________。
(3)对比实验I和IV,可以研究________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体判断正确的是
A. 甲苯的一氯代物有4种
B. 分子式为C8H10的芳香烃有3种
C. 分子式为C4H8的烯烃同分异构体有2种,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D. 二氯甲烷有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
I.甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 _____________________________。
II.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度______(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则______(填“甲”或“乙”)判断正确,试剂X是______(填字母序号)。
A.Ba(OH) 2溶液B.BaCl2溶液C.NaOH溶液D.澄清石灰水。
(2)将加热后的溶液冷却到10℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则______(填“甲”或“乙”)判断正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
![]() ―→
―→![]()
某化学兴趣小组将上述流程②③设计成如图所示:

已知②中发生反应的化学方程式为Cl2+2KI=2KCl+I2
回答下列问题:
(1)写出提取过程①③中实验操作名称:①____,③____。
(2)四氯化碳是____色、密度比水____的液体。Y中下层液体的颜色为___色,上层液体中溶质的主要成分为_____。
(3)从碘的四氯化碳溶液中得到碘需进行的操作是______。
(4)在操作①过程中,使用到的实验仪器有____(多选)。
A.试管 B.烧杯 C.玻璃棒 D.蒸发皿 E.漏斗 F.铁架台 G.分液漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com