
【题目】下列物质中,互为同分异构体的是
A.蔗糖和麦芽糖B.淀粉和葡萄糖
C.淀粉和纤维素D.果糖和蔗糖
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于乙酸的下列叙述中错误的是( )
A.乙酸是有刺激性气味的液体,是食醋的主要成分
B.乙酸具有酸的通性,可以使石蕊等指示剂变色
C.乙酸在常温下可以发生酯化反应
D.乙酸可以和NaHCO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机化合物A 6.8g,完全燃烧后生成3.6g水和8.96LCO2 (标准状况),已知该有机物的蒸汽对氢气的相对密度为68,则该有机物的分子式为________________ 。
(2)该有机物A的核磁共振氢谱和红外光谱如下:
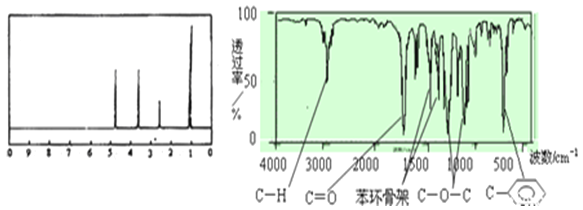
试推测有机物A的结构简式为____________________________ 。
(3)与A属于同类有机物的同分异构体共_____ 种,其结构简式分别为(不一定填满空格)
①________________ ② ③
④ ⑤ ⑥ ……
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
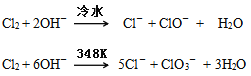
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型支管试管中装有1.5gKMnO4;③微型支管试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有2mol/LNaOH溶液;⑥、⑦双U形反应管中分别装有0.1mol/LKI-淀粉溶液和KBr溶液;⑧尾气出口用浸有0.5mol/LNa2S2O3溶液的棉花轻轻覆盖住

(1)整套装置气密性检查的方法_________________________。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为________________________________。
(3)装置⑥、⑦中能够观察到的实验现象分别是____________________。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:Cl2>I2,______(填“能”或“不能”),理由是:______________。
(5)已知氯酸钾和氯化钾的溶解度曲线如下图所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是_____________。
(6)尾气处理时发生反应的离子方程式为____________________。
(7)选择微型实验装置的优点有___________________(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作制氧剂、漂白剂。
(1)已知:2CrO42ˉ+2H+![]() Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
(2)某化学兴趣小组同学欲在实验室中制备少量Na2O2。
查阅资料得知,将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453—473K之间,钠即被氧化为Na2O;进而增加空气流量并迅速提高温度至573—673K,即可制得Na2O2。
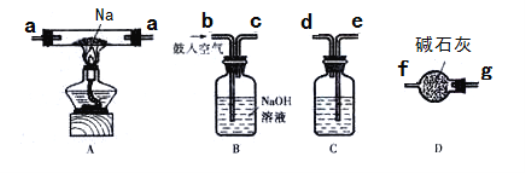
①若采用上述仪器装置制备Na2O2,从左到右仪器的连接顺序为(填接口字母,各装置只能用一次)________;装置D的作用为________。
②装置A中生成Na2O2的化学反应方程式为_______________________。
③若实验时准确称取2.3 gNa进行反应,将反应后的固体溶于1L水中,向所得溶液中加入50 mL 0.5 mol/L NH4Al(SO4)2溶液充分反应,请写出加入NH4A1(SO4)2溶液后发生反应的离子方程式________。
(3)小组同学继续对反应后固体的组成进行探究。
a.取一定量反应后固体,加入足量水充分反应,有气体生成;
b.将生成的气体全部转入真空密闭容器中,放电后充分反应,气体体积减少了3 / 5(不考虑O3的生成)。
①反应后固体中一定有的物质为________(填化学式)。
②为进一步确定反应后固体的组成,需对b中剩余气体继续进行猜想与设计,请完成下表。
猜想 | 实验设计 | 现象与结论 |
剩余气体为___________。 | _______________________________。 | 若看到____________ 证明此猜想正确,反之则不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
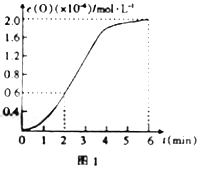
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
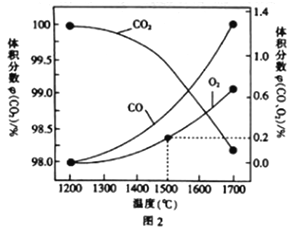
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
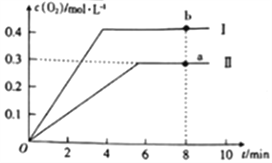
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列离子方程式:______
Ce3++ H2O2+ H2O === Ce(OH)4↓+_______H+
(2)已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,逐渐滴入NaOH溶液至溶液呈碱性,在此过程中没有沉淀和气体产生,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
①写出第三步加热该溶液后,有气体生成的反应的离子方程式:_________________;
②待测液中一定含有_______和NO3-离子,一定不含有_________离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称)___________。
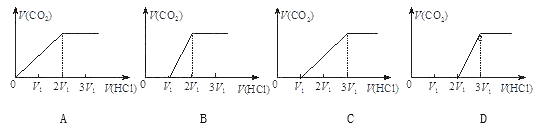
③往含等物质的量CO32-和HCO3-的溶液中滴入HCl溶液,下列表示产生的气体在标准状况下的体积与加入的HCl溶液体积关系图正确的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com