
【题目】一种新型的合成氨的方法如图所示,下列说法正确的是
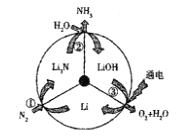
A. 反应①属于“氮的固定”B. 反应②属于氧化还原反应
C. 反应③可通过电解![]() 水溶液实现D. 上述三步循环的总结果为:
水溶液实现D. 上述三步循环的总结果为:![]()
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 氨水加水稀释后,溶液中所有离子的浓度都减小
氨水加水稀释后,溶液中所有离子的浓度都减小
B. 将![]() 溶液与
溶液与![]() 溶液混合可制取
溶液混合可制取![]()
C. 直接蒸干![]() 溶液就可以得到
溶液就可以得到![]() 固体
固体
D. 浓度相同的①![]() ;②
;②![]() ;③
;③![]() 。三种溶液中的
。三种溶液中的![]() :③>①>②
:③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“要想做好实验,就要敏于观察。”——波义耳。体弱多病的波义耳为给自己治病自修医 学,到处寻方问药。自己配制药物,所以研究医学必须研制药物和做实验。下列有关实验的 选项正确的是( )
A.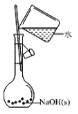 配制 0.10 mol/L NaOH 溶液B.
配制 0.10 mol/L NaOH 溶液B. 除去 CO 中的 CO2
除去 CO 中的 CO2
C.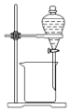 用来分离乙醇和水D.
用来分离乙醇和水D.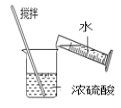 稀释浓硫酸
稀释浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3 =K2O+5X+16N2↑,下列说 法不正确的是( )
A.X 的化学式为 Na2O
B.上述反应中 NaN3 被氧化,KNO3 发生还原反应
C.每生成 1.6molN2,则转移的电子为 3 mol
D.若被氧化的 N 原子的物质的量为 3mol,则氧化产物比还原产物多 1.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1684 年,波义耳出版了一部名为《人血的自然史略》的医学著作,在这本书里, 他总结了自己在血液分析方面的实验成果。这是有史以来,人类第一次将化学分析方法用于 临床医学。通过实验,波义耳证明了血液中含有氯化钠,并将之称为固定盐。科研人员从海水得到的粗盐中含有泥沙等不溶性杂质,以及可溶性杂质:Ca2+,Mg2+,SO42-等,提纯的流程如下图:
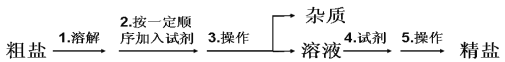
(1)整个流程中首先将粗盐溶解,再通过以下实验步骤进行提纯:①过滤②加过量 NaOH 溶 液③加适量盐酸④加过量 Na2CO3 溶液⑤加过量 BaCl2 溶液。
以下操作顺序不合理的是_____(填字母)
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
除去 Mg2+的离子方程式_________。
(2)实验室将上述得到的精制食盐水制成精盐的过程中,还需要进行某一操作,该操作中 需要加热的仪器为:_____。
(3)下列实验仪器,可用酒精灯直接加热的是_______(填字母)
①试管 ②量筒 ③圆底烧瓶 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙
A. ①③④⑥⑦ B. ①⑦ C. ①③④⑤⑥ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
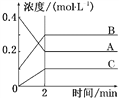
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种表示集合的图案,该图案中由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:
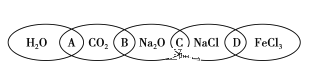
(1)请将分类依据代号填入相应的括号内:
(_____)两种物质都是非金属氧化物
(_____)两种物质都是钠的化合物
(_____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(_____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为____。
②证明有红褐色胶体生成的最常用的实验操作是____。
③生成该胶体的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A.12.0gNaHSO4溶于1L水中,溶液中氢离子的浓度为0.1mol/L
B.25℃时气体的摩尔体积大于22.4L/mol
C.阿伏加德罗常数近似为6.02×1023
D.氦气的摩尔质量是4g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如图:
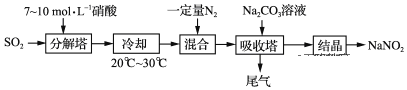
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是____。
(2)“分解塔”中的温度不宜过高,其原因是____。
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1:1,则“分解塔”中发生反应的化学方程式为____。
(4)为提高氮氧化物的转化率,可向“尾气”中通入一定量的____气体,再通入“吸收塔”中,实现循环吸收。
(5)“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为___(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com