
【题目】下列各组混合物中,用分液漏斗能分离的是
A. 苯和甲苯 B. 正己烷和水 C. 乙酸和乙醇 D. 碘和四氯化碳
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集两瓶干燥纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:

(1)写出Ⅰ装置烧瓶中发生的反应的化学方程式________________________________。
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是___________________________;装置Ⅲ的作用是干燥氯气,应盛放_________________________。
(3)实验开始后,先________a,_________b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外逸,再_________a,________b,换好集气瓶后,继续收集氯气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是(填序号)_____________。
①氢氧化钠溶液 ②浓硫酸 ③水
(5)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为_______________,漂白粉的有效成分是____________________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答问题:
Ⅰ.(1)25℃时,水的离子积Kw值为____________。
(2)在T℃的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:

①T℃下,水的离子积为_______________。
②T℃下,0.01 mol/L NaOH溶液中c(H+) 为____________mol/L。
Ⅱ.25℃时,电离平衡常数如下。回答下列问题:
化学式 | CH3COOH | H2S | HClO |
电离平衡常数 | 1.8×10-5 | K1=1.3×10-7 K2=7.1×10-15 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种物质:
a.Na2S b.NaClO c.CH3COONa d.NaHS
pH由大到小的顺序是____________________(填序号)。
(2)25℃时,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是___________________。
a.c(H+) b.c(H+)/c(CH3COOH) c.c(H+)·c(OH-)
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中 c(CH3COO-)-c(Na+)=______________mol/L(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法。请回答下列问题:
(1)电解精制食盐水,电解槽中的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许阳离子通过,而不允许_____________(填离子符号)和气体通过。
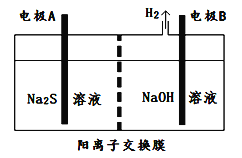
(2)氯碱工业中获得的烧碱可以吸收有毒气体H2S,吸收后的溶液加入到如图所示的电解池的阳极区进行电解以获取单质硫。
①Na2S溶液显碱性的原因(离子方程式):____________________________________________________________。
②电极A应该与直流电源的____________相连。A电极反应为________________________________________________。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电、节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出。
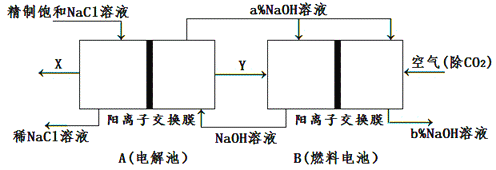
①图示中电极产物X、Y分别是____________、____________(填化学式)。图示中氢氧化钠溶液质量分数大小:a%______b%(填“﹥”“﹤”或“=”)。
②燃料电池B中正极的电极反应:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的KI溶液和0.05mol/LFe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的叙述中不正确的是( )
A.钠和钾的合金可用于快中子反应堆作热交换剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
C.明矾溶于水后能产生Al(OH)3胶体,可用作净水剂
D.在医疗上,可用碳酸钠治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,VmL不饱和NaNO3溶液ag,蒸发掉bg水或加入bg NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )
A. 该温度下NaNO3的溶解度为100 g
B. 原不饱和溶液中NaNO3质量分数为![]() %
%
C. 原不饱和溶液中NaNO3物质的量浓度为![]() mol·L-1
mol·L-1
D. 原不饱和溶液的密度为![]() g·mL-1
g·mL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com