
【题目】铜 - 锌原电池如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是
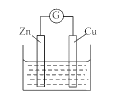
A. 锌电极上的反应为Zn- 2e-=Zn2+
B. 溶液中的SO42-向锌电极移动
C. 电子从锌电极经过硫酸铜溶液流向铜电极
D. 铜电极质量增加
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )

A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。(填“变浅”“变深”或“不变”)
Ⅱ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
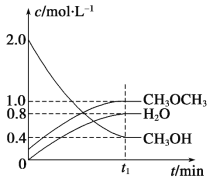
(1)该条件下反应平衡常数表达式K=___________________________;在t1 ℃时,反应的平衡常数为___________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向______反应方向进行(填“正”或“逆”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. HC1的电子式:![]() B. CO2的比例模型:
B. CO2的比例模型: ![]()
C. 乙酸的分子式:CH3COOH D. 甲烷的实验式为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)=2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A. 平衡时,容器内的压强是起始时的 ![]()
B. x值等于3
C. A的转化率为20%
D. B的平均反应速率为0.4 mol·L-1·min-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,根据表中信息回答下列问题。
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远。且其单质燃烧后生成淡黄色固体 |
B | 单质非常稳定,是空气的主要成分之一。其原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是黄绿色气体,原子的M层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表四种元素名称分别为:A____,B____,C____,D____。
(2)A、B、C、D原子半径由大到小的顺序为___。(用元素符号填写)
(3)写出B的气态氢化物与其最高价氧化物对应的水化物反应的离子方程式____。
(4)用电子式表示AC的形成过程____。
(5)C元素的单质的氧化性比溴单质的氧化性____(填“强”或“弱”),请设计实验证明___。(写实验操作和现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氧化还原反应的本质是电子的转移
B.化合反应一定是氧化还原反应
C.物质中某元素的原子得到电子,则此物质是还原剂
D.酸、碱、盐之间的反应一定是复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物在许多方面有着广泛的应用。下列叙述不正确的是
A.CuSO4溶液呈天蓝色是因为含有[Cu(H2O)4]2+
B.魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液
C.[Ag(NH3)2]+是化学镀银的有效成分
D.除去硝酸银溶液中的Ag+,可向其中逐滴加入氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com