
����Ŀ��Ԫ��A��D��Ԫ�����ڱ��ж����ڵ�����Ԫ�أ����ݱ�����Ϣ�ش��������⡣
Ԫ�� | ���ʻ�ṹ��Ϣ |
A | �����Ƴɵĸ�ѹ�ƣ������Ļƹ�����ǿ�����Զ�����䵥��ȼ�պ����ɵ���ɫ���� |
B | ���ʷdz��ȶ����ǿ�������Ҫ�ɷ�֮һ����ԭ�ӵ��������������ڲ����������2.5�� |
C | ������˫ԭ�ӷ��ӣ����¡���ѹ���ǻ���ɫ���壬ԭ�ӵ�M��������һ�����Ӽ��ﵽ�ȶ��ṹ |
D | +2�������ӵĺ�������Ų�����ԭ����ͬ |
(1)�ϱ�����Ԫ�����Ʒֱ�Ϊ��A____��B____��C____��D____��
(2)A��B��C��Dԭ�Ӱ뾶�ɴ�С��˳��Ϊ___������Ԫ�ط�����д��
(3)д��B����̬�⻯����������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ____��
(4)�õ���ʽ��ʾAC���γɹ���____��
(5)CԪ�صĵ��ʵ������Ա��嵥�ʵ�������____������ǿ�������������������ʵ��֤��___����дʵ�����������
���𰸡� �� �� �� þ Na>Mg>Cl>N NH3��H��=NH4�� ![]() ǿ ��NaBr��Һ��ͨ��Cl2 ���ٵ���CCl4 �����Թܣ�ͨ��Cl2����Һ�ʳȺ�ɫ������CCl4���ϲ���Һ����ɫ���²���Һ���غ�ɫ
ǿ ��NaBr��Һ��ͨ��Cl2 ���ٵ���CCl4 �����Թܣ�ͨ��Cl2����Һ�ʳȺ�ɫ������CCl4���ϲ���Һ����ɫ���²���Һ���غ�ɫ
��������AԪ�صĵ����Ƴɵĸ�ѹ�ƣ������Ļƹ�����ǿ�����Զ�����䵥��ȼ�պ����ɵ���ɫ���壬A��Na��BԪ�صĵ��ʷdz��ȶ����ǿ�������Ҫ�ɷ�֮һ����ԭ�ӵ��������������ڲ����������2.5����������������5����B��N��CԪ�صĵ�����˫ԭ�ӷ��ӣ����¡���ѹ���ǻ���ɫ���壬ԭ�ӵ�M��������һ�����Ӽ��ﵽ�ȶ��ṹ��C��Cl��DԪ�ص�+2�������ӵĺ�������Ų�����ԭ����ͬ��ԭ��������10+2��12��D��Mg���ݴ˽��
�������Ϸ�����֪A��Na��B��N��C��Cl��D��Mg����
(1)�������Ϸ�����֪�ϱ�����Ԫ�����Ʒֱ�Ϊ������������þ��
(2)ͬ������������ԭ�Ӱ뾶��С��ͬ������ϵ���ԭ�Ӱ뾶��������A��B��C��Dԭ�Ӱ뾶�ɴ�С��˳��ΪNa��Mg��Cl��N��
(3)N����̬�⻯�ﰱ����������������Ӧ��ˮ�������ᷴӦ�����ӷ���ʽΪNH3��H��=NH4����
(4)AC���Ȼ��ƣ��������Ӽ������γɹ��̿ɱ�ʾΪ![]() ��
��
(5)ͬ������ϵ��·ǽ�������������ClԪ�صĵ��ʵ������Ա��嵥�ʵ��������������Ը��������ܰ�����������Ϊ������֤��������NaBr��Һ��ͨ��Cl2���ٵ���CCl4�����Թܣ�ͨ��Cl2����Һ�ʳȺ�ɫ������CCl4���ϲ���Һ����ɫ���²���Һ���غ�ɫ����˵��������������ǿ�ڵ����塣


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AgNO3����ѧ��ѧ�����Լ���ij��ȤС���������ʵ��̽�������ʡ�
I. AgNO3�����ȶ���
AgNO3�����ֽ⣬����ͼװ�ü���AgNO3���壬�Թ����к���ɫ�������ɣ�һ��ʱ�����ĩ�˵��ܿڿ��ռ�����ɫ����a��

(1)ʵ���Ҽ�������a�ķ���Ϊ_______________________________________��
(2)��֪B��ֻ����һһ���Σ��ݴ��ж�AgNO3���ȷֽ�Ļ�ѧ����ʽΪ______________��
(3)�Ӱ�ȫ�Ƕȿ��ǣ�����ʵ��װ�ô���һ������ȱ�ݣ��Ľ���ʩΪ______________________��II. AgNO3������Һ�ķ�Ӧ

(4)��ͬѧ��Ϊ�Թܢ��в���������Fe2+���£������ӷ���ʽΪ_____________________��
��ͬѧ��ΪҪ�жϸù۵���ȷ������������ʵ�飬ȡ2 mL0.5mol/L AgNO3��Һ����Ӫ�У����������Ӽ���____________����ֻ������ɫԶ����֤����ͬѧ�۵���ȷ��
(5)��֪��AgSCNΪ��ɫ�������Թܢ��к�ɫ��ȥ��ԭ��Ϊ__________________________(���ƽ���ƶ��ĽǶȽ���)��
(6)���ʵ��֤��Ksp(AgI)sp(AgSCN)��
��ѡ�Լ���0.1 mol/L AgNO3��Һ��0.1mol/LKI��Һ��0.1mol/LKSCN ��Һ___________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2��H2�ϳ�NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��( )

A. N2(g)��3H2(g) �� 2NH3(g) ����H �� 2(b��a) kJ/mol
B. N2(g)��3H2(g) �� 2NH3(l)�� ��H �� 2(a��b��c) kJ/mol
C. N2(g)��3H2(g) �� 2NH3(l) ����H �� (b��c��a) kJ/mol
D. N2(g)��3H2(g) �� 2NH3(g) ����H �� (a��b) kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ - пԭ�����ͼ��ʾ���������ҺΪ����ͭ��Һ����ع���һ��ʱ�������˵���������
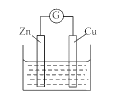
A. п�缫�ϵķ�ӦΪZn- 2e-=Zn2+
B. ��Һ�е�SO42-��п�缫�ƶ�
C. ���Ӵ�п�缫��������ͭ��Һ����ͭ�缫
D. ͭ�缫��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��XԪ�ص�1��ԭ��ʧȥ2�����ӣ���YԪ�ص�2��ԭ�Ӹ����1���������γ����ӻ�����Z������˵���в���ȷ���� (����)
A. ��̬Z�����Ӿ���
B. Z���Ա�ʾΪX2Y
C. ��̬Z�ۻ����ܵ���
D. X���γɣ�2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)��ͼ�б�ʾNO2�ı仯��������___________(����ĸ);
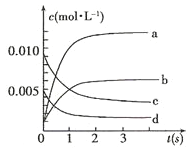
(2)800�棬��Ӧ�ﵽƽ��ʱ��NO��ת������___________��
(3)��O2��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v=___________��
��һ���������İ��������(NH2COONH4)�������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)+CO2(g)��
2NH3(g)+CO2(g)��
(1)���в����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ��״̬����___________(��ѡ��);
A��2v��(NH3)=v��(CO2) B���ܱ������а��������ʵ�������
C��������CO2��NH3�����ʵ���֮�ȱ��ֲ��� D���ܱ���������ѹǿ���ֲ���
E���γ�6��N-H����ͬʱ��2��C=O������
(2)��ʹ�÷�Ӧ�ķ�Ӧ�����������___________(��ѡ��);
A����ʱ�����CO2���� B���ʵ������¶�
C����������NH2COONH4(s) D��ѡ���Ч����
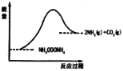
(3)��ͼ��ʾ��������Ӧ�жϿ���Ӧ���л�ѧ�����յ�����___________�γ��������л�ѧ���ų�������(��д�����ڡ������ڡ���С�ڡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ�ҵ�ϳɰ���Ӧ��N2+3H22NH3 �� ����˵��������ǣ� ��
A.ʹ�ú��ʵĴ������ԼӴ�Ӧ����
B.�����¶ȿ�������Ӧ����
C.����N2Ũ�ȿ���ʹH2ת���ʴﵽ100%
D.����N2Ũ�ȿ�������Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ݵıȽϣ�����ȷ����( )
A. Ԫ�صļ۵�����������������������
B. NaOH�����е������Ӻ���������Ŀ���
C. CsCl������ÿ��Cs����Χ���ڵ�Cl����ÿ��Cl����Χ���ڵ�Cs���������
D. [Co(NH3)6]3���е�NH3����������λ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ�ص�ԭ������ԭ�������ĵ������йصݱ䲻��ȷ���ǣ� ��
A.������ۣ�P��S��Cl��Ar
B.�����ԣ�Na��K��Rb��Cs
C.ԭ�Ӱ뾶��C��N��O��F
D.������������Na��Mg��Al��Si
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com