
 请根据如图所示实验过程和数据计算:
请根据如图所示实验过程和数据计算:| 13g×2 |
| 65 |
| 13g×98 |
| 65 |


科目:高中化学 来源: 题型:
| A、苯酚沾在手上立即用酒精洗涤 |
| B、误食铜盐立即喝牛奶或蛋清 |
| C、鱼、肉等食品用福尔马林浸泡防腐保鲜 |
| D、皮肤沾上了浓HNO3而变黄色,立即用饱和NaOH溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16O转化为18O不是化学变化 |
| B、汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
| C、t℃时,1L pH=6的纯水中OH-的数目为10-8NA |
| D、同一物质不同聚集状态下分子间的平均距离都是:d(气态)>d(液态)>d(固态) |
查看答案和解析>>
科目:高中化学 来源: 题型:
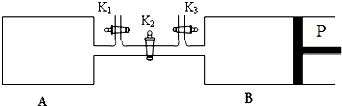
查看答案和解析>>
科目:高中化学 来源: 题型:
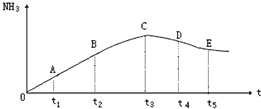 在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:
在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
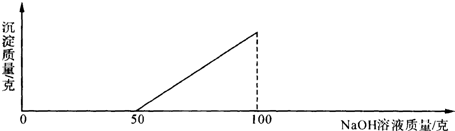
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com