
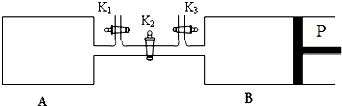
| ||
| 2 |
| 总质量 |
| 体积 |
| 总质量 |
| 总物质的量 |
| 0.5×3 |
| 3 |


科目:高中化学 来源: 题型:
| A、小红提出:呼出的气体水蒸气含量比空气中水蒸气含量少 |
| B、取用石灰水时,实验设计中未说明用量,小东取了1.5ml |
| C、亮亮认为在人呼出的气体中有一氧化碳 |
| D、小红认为人呼出的气体只有二氧化碳存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a mol-1 | ||
B、
| ||
| C、32a mol-1 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| 放电 |
| 充电 |
| 1 |
| 2 |
| 容器编号 | c(co)/mol/L | c(o2)/mol/L | c(co2)/mol/L | V正和V逆比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-4 | V正=V逆 |
| Ⅱ | 1.0×10-3 | 4.0×10-4 | 5.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
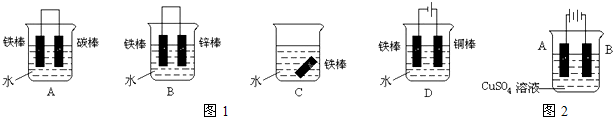
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com