
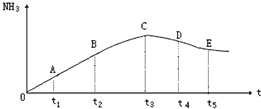
 在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:
在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、容器内的总压不随时间变化 |
| B、单位时间生成nmol的A2同时生成2nmol的AB |
| C、单位时间生成2nmol的AB同时消耗nmol的B2 |
| D、单位时间生成nmol的A2同时生成nmol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
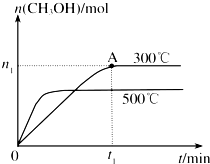 甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g)
甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g)查看答案和解析>>
科目:高中化学 来源: 题型:
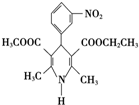 尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下:
尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com