
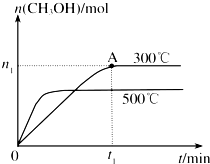
 �״���һ�ֿ�����ȼ�ϣ����ݻ�Ϊ2L���ܱ������н��з�Ӧ��CO��g��
�״���һ�ֿ�����ȼ�ϣ����ݻ�Ϊ2L���ܱ������н��з�Ӧ��CO��g��
| ||
| t1min |
| n1 |
| 2t1 |
| n1 |
| 2t1 |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.25 |
| 0.75��12 |
| 440g |
| 44g/mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Zn+HCl |
| B��Cu+HCl |
| C��Al+NaOH��Һ |
| D��Fe+H2O�� g�����£� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
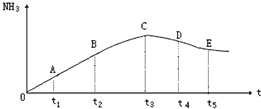 ���ݻ�������ܱ������У��ֱ����1.0mol N2��3.0molH2�����䷢����Ӧ��
���ݻ�������ܱ������У��ֱ����1.0mol N2��3.0molH2�����䷢����Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
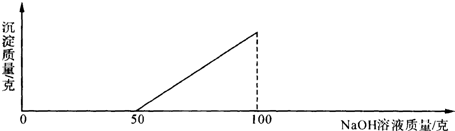
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� ���� | A | B | C | D | E | F | G | M | I | J | K |
| ԭ�Ӱ뾶 ��10-10m�� | 1.02 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.54 | 0.75 | 1.17 | 1.34 |
| ���̬ | +6 | +1 | --- | +3 | +4 | +5 | +7 | +1 | +5 | +4 | +1 |
| ��ͼ�̬ | -2 | --- | -2 | --- | -4 | -3 | -1 | --- | -3 | -4 | --- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com