
| A. |  | B. |  | C. |  | D. |  |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应在需要在加热条件下才能发生 | |
| D. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
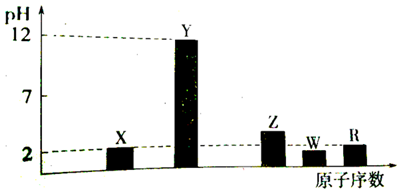
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX、HY均为弱酸 | |
| B. | a点由水电离出的c(H+)=1.0×l0-13mol•L-l | |
| C. | c点溶液中:c(Y-)<c(Na+)<c(HY) | |
| D. | b点时,溶液的pH=7,酸碱恰好完全中和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com