
【题目】废旧钴金属片中的钴有+2 价和+3 价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回 收钴的工艺流程:
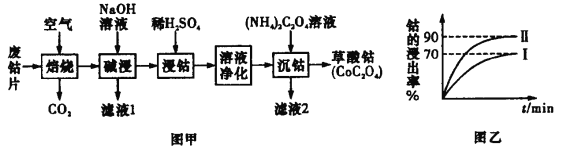
已知:①焙烧后 Mn 元素的化合价为+2
②
物质 | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
溶度积 | 4×10-9 | 5.3×10-9 | 4×10-3 | 5×10-6 | 6.4×10-9 | 1.7×10-7 |
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是_____________(任写一条)。
(2)滤液 1 含有的阴离子是 ____________ 。
(3)该流程中浸钴时,钴的浸出率最高只能达到 70%,后来改进方法,加入使用硫酸进行第一次浸取后, 再加入 Na2SO3 溶液进行第二次浸取,从而使钴的浸出率达 90%以上,写出第二次浸出钴时溶液中发生反 应的离子方程式:___________________
(4)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液 pH 为 1.5~2.0 后,加 H2O2,反应一段时间,加 8%Na2CO3 溶液,将溶液 的 pH 调至 4.0~5.0。请用化学平衡移动原理解释加入 Na2CO3 溶液能除去溶液中铁元素的原因____________。
②除锰:加入 NaClO 溶液。写出该离子方程式:___________________。
③减钙镁:加入 NH4F 溶液,沉淀大部分的钙、镁的离子。 试解释为何草酸铵溶液沉钴前要减钙镁:_____。
(5)树德中学化学兴趣小组欲探究 CoC2O42H2O 受热后的分解产物,取 5.49gCoC2O42H2O(摩尔质量为183g/mol)于硬质玻璃管中加热一段时间,冷却、称量,剩余氧化物固体的质量为 2.41g。书写 CoC2O42H2O受热分解的化学方程式___________________________________。
【答案】将废旧钴片粉碎或适当增大空气的进气量 AlO2-、OH- ![]() 或
或![]() 溶液中存在铁离子的水解平衡:
溶液中存在铁离子的水解平衡:![]() ,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀
,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀 ![]() 草酸钴的溶度积比草酸钙大,与草酸镁很接近,先减少钙、镁离子的浓度,可以避免再沉钴时引入钙、镁杂质
草酸钴的溶度积比草酸钙大,与草酸镁很接近,先减少钙、镁离子的浓度,可以避免再沉钴时引入钙、镁杂质 ![]()
【解析】
由流程图可知,废钴片在空气中焙烧后,生成钴、锰、铁的氧化物以及氧化镁、氧化铝、氧化钙、二氧化碳等,加入氢氧化钠溶液碱浸可以与氧化铝反应生成偏铝酸钠,从而过滤除去,然后再用稀硫酸浸取钴元素,使其转化为离子,同时锰、铁、钙、镁元素也转化为相应的离子,再经过溶液净化除去铁、锰、钙、镁,最后用草酸铵溶液沉淀钴离子,得到草酸钴,据此分析解答。
(1)将废旧钴片粉碎或适当增大空气的进气量,可以在焙烧时使废旧钴金属片充分反应,故答案为:将废旧钴片粉碎或适当增大空气的进气量;
(2)加入氢氧化钠溶液碱浸,Al2O3与氢氧化钠反应生成偏铝酸钠,则滤液 1 的溶质为偏铝酸钠和过量的氢氧化钠,则含有的阴离子是AlO2-、OH-,故答案为:AlO2-、OH-;
(3)Na2SO3具有还原性,可以将+3价钴的氧化物还原为+2价钴离子,发生反应的离子方程式为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(4)①加H2O2,可以将Fe2+氧化为Fe3+,在溶液中存在铁离子的水解平衡:![]() ,则向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀,故答案为:溶液中存在铁离子的水解平衡:
,则向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀,故答案为:溶液中存在铁离子的水解平衡:![]() ,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀;
,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀;
②NaClO具有强氧化性,可以将Mn2+氧化为MnO2,从而过滤除去,发生反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
③由表格中的溶度积数据可知,草酸钴的溶度积比草酸钙大,与草酸镁很接近,则为了避免在沉钴时,将钙离子、镁离子同时沉淀,应先加入NH4F溶液,沉淀大部分的钙、镁的离子,再加入草酸沉淀钴离子,故答案为:草酸钴的溶度积比草酸钙大,与草酸镁很接近,先减少钙、镁离子的浓度,可以避免在沉钴时引入钙、镁杂质;
(5)5.49g CoC2O42H2O的物质的量为![]() ,则剩余的钴的氧化物固体中氧元素的物质的量为
,则剩余的钴的氧化物固体中氧元素的物质的量为![]() ,则该氧化物中Co与O元素物质的量之比为3:4,则该钴的氧化物的化学式为Co3O4,由此可知部分Co的化合价升高,失电子,则C元素应得电子,化合价降低,生成CO,根据得失电子守恒、元素守恒配平该方程式,还应有CO2和H2O生成,故发生反应的化学方程式为
,则该氧化物中Co与O元素物质的量之比为3:4,则该钴的氧化物的化学式为Co3O4,由此可知部分Co的化合价升高,失电子,则C元素应得电子,化合价降低,生成CO,根据得失电子守恒、元素守恒配平该方程式,还应有CO2和H2O生成,故发生反应的化学方程式为![]() ,故答案为:
,故答案为:。


科目:高中化学 来源: 题型:
【题目】用两种不饱和烃A和D为原料可以合成一类新药有机物J ,合成路线如下:

已知①
②有机物J结构中含两个环。
回答下列问题:
(1)C的名称是________________。
(2)A→B试剂和反应条件为________________。
(3)H→J的化学反应方程式为_______________。
(4)已知![]() 符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
符合下列条件的 N的同分异构体有___________种,其中核磁共振氢谱显示环上只有 3 组峰,且峰面积之比为 4:4:1,写出符合条件一种同分异构体的结构简式____________。
①含有基团![]() 、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是_____。
、环上有三个取代基②与NaHCO3反应产生气泡 ③可发生缩聚反应,M的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同是_____。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(5)利用题中信息和所学知识,写出以A和甲烷为原料,合成![]() 的路线流程图____________(其它试剂自选)。
的路线流程图____________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,以及少量Fe、Si的化合物,可以用孔雀石为原料制备胆矾( CuSO4·5H2O),步骤如下:
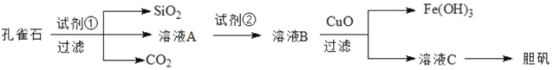
回答下列问题:
(1)试剂①是一种常见的酸,其化学式为______。过滤所需要的玻璃仪器有烧杯、__________。
(2)实验室检验 Fe3+的常用方法是_____________________________________ 。
(3)若溶液A中的金属离子有Cu2+、Fe2+ 、Fe3+,上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液 B,则试剂②能否使用氯水?(填“能”或“不能”,若填“不能”,请解释原因)。_________________
(4)由溶液C获得胆矾,需要经过_______、_____、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/L的 KMnO4标准溶液滴定。反应离子方程式为:5Fe2++ MnO4-+8H+=5Fe3+ Mn2+ +4H2O,若消耗标准溶液 20.00mL,则溶液A 中Fe2+的浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.苯乙烯和苯均能使溴水褪色,且原理相同
B.用饱和 Na2CO3 溶液可鉴别乙醇、乙酸、乙酸乙酯
C.用 Ni 作催化剂,1mol 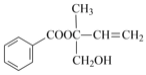 最多能与 5molH2 加成
最多能与 5molH2 加成
D.C3H6BrCl 的同分异构体数目为 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6 的结构式为_____;(标出配位键)其中 Al 的配位数为_________。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____种。
(4)Co2+的价电子排布式_________。NH3 分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小”或“相同”),解释原因_____。
(5)已知 CrO5 中铬元素为最高价态,画出其结构式:_____。
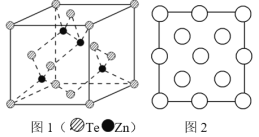
(6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加德罗常数 NA=_____mol-1(列计算式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是( )

A.分子中所有的原子共面
B.1molEGC与4molNaOH恰好完全反应
C.易发生氧化反应和取代反应,难发生加成反应
D.遇FeCl3溶液不发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)。在某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是

A.向混合溶液中加水,平衡逆向移动
B.反应I2(aq)+I-(aq)I3-(aq)的H<0
C.状态A与状态B相比,I2的消耗速率A<B
D.状态C与状态D相比,反应的平衡常数KC=KD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com