
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)。在某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是

A.向混合溶液中加水,平衡逆向移动
B.反应I2(aq)+I-(aq)I3-(aq)的H<0
C.状态A与状态B相比,I2的消耗速率A<B
D.状态C与状态D相比,反应的平衡常数KC=KD
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】废旧钴金属片中的钴有+2 价和+3 价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回 收钴的工艺流程:
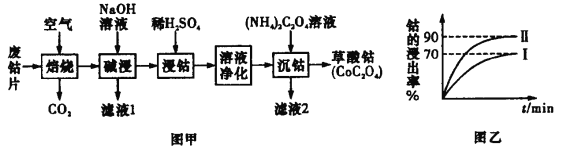
已知:①焙烧后 Mn 元素的化合价为+2
②
物质 | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
溶度积 | 4×10-9 | 5.3×10-9 | 4×10-3 | 5×10-6 | 6.4×10-9 | 1.7×10-7 |
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是_____________(任写一条)。
(2)滤液 1 含有的阴离子是 ____________ 。
(3)该流程中浸钴时,钴的浸出率最高只能达到 70%,后来改进方法,加入使用硫酸进行第一次浸取后, 再加入 Na2SO3 溶液进行第二次浸取,从而使钴的浸出率达 90%以上,写出第二次浸出钴时溶液中发生反 应的离子方程式:___________________
(4)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液 pH 为 1.5~2.0 后,加 H2O2,反应一段时间,加 8%Na2CO3 溶液,将溶液 的 pH 调至 4.0~5.0。请用化学平衡移动原理解释加入 Na2CO3 溶液能除去溶液中铁元素的原因____________。
②除锰:加入 NaClO 溶液。写出该离子方程式:___________________。
③减钙镁:加入 NH4F 溶液,沉淀大部分的钙、镁的离子。 试解释为何草酸铵溶液沉钴前要减钙镁:_____。
(5)树德中学化学兴趣小组欲探究 CoC2O42H2O 受热后的分解产物,取 5.49gCoC2O42H2O(摩尔质量为183g/mol)于硬质玻璃管中加热一段时间,冷却、称量,剩余氧化物固体的质量为 2.41g。书写 CoC2O42H2O受热分解的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素,它们在周期表中的位置如图所示,下列说法正确的是( )

A.四种元素的原子半径由小到大的顺序为r(X)<r(Z)<r(W)<r(Y)
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D.H2Z与HW所含的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
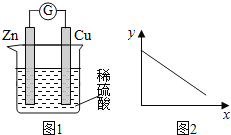
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过下列实验探究了物质的溶解度大小、反应物浓度与沉淀转化方向之间的关系。
已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) |
|
|
|
|
(1)探究BaCO3和BaSO4之间的转化
实验操作:
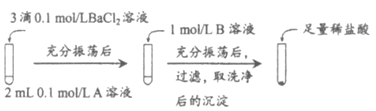
试剂A | 试剂B | 加入盐酸后的现象 | |
实验Ⅰ | Na2CO3 | Na2SO4 | 无明显现象 |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ中加入A溶液后生成沉淀的离子方程式为_____________。
②实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因________。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
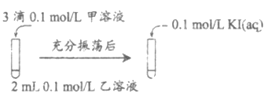
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| p>装置 | 步骤 | 电压表读数 |
| i. 如图连接装置并加入试剂,闭合K | a |
ii. 向B中滴入AgNO3(aq),至沉淀完全 | b | |
iii. 再向B中投入一定量NaCl(s) | c | |
iv. 重复i,再向B中加入与iii等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液是_____________(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
②实验Ⅳ中结合信息,解释电压b<a的原因:_____________。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_____________。
(3)综合实验Ⅰ~Ⅳ,下列说法正确的是_____________(填序号)。
a. 溶解度小的沉淀只能转化成溶解度更小的沉淀
b. 电化学是研究物质性质和转化的重要手段之一
c. 某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化
d. 溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在 1标准大气压、25℃ 下,1mol 气态 AB 分子生成气态 A 原子和 B 原子的过程中所吸收的能量称为AB间共价键的键能,已知水分子的能量变化关系图如下:

下列说法正确的是
A.△H1<0,且△H3 <△H4
B.△H4 是 O2的键能
C.△H5 =△H1+△H2+△H3+△H4
D.△H3+△H4 >△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.恒温恒容密闭容器中反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡
2NH3(g)+CO2(g),混合气体的压强不再改变时说明反应已达平衡
B.汽车尾气催化净化时的反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2
N2(g)+2CO2(g) ΔH < 0 ,平衡常数为K1;若反应在绝热容器中进行,平衡常数为K2;则K1 < K2
C.某恒容密闭容器中反应:nA(g)+mB(g)![]() pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大
pC(g)+qD(g) ΔH > 0已达平衡,则降温时c(B)/c(C)的值增大
D.2NO2(g) ![]() N2O4(g)在常温下即可进行,说明正反应是放热反应
N2O4(g)在常温下即可进行,说明正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核外p能级、d能级等原子轨道上电子排布为“全空”“半满”“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实不能作为这个规则的证据的是( )
A.硼元素的第一电离能小于铍元素的第一电离能
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态铜原子的核外电子排布式为![]() 而不是
而不是![]()
D.某种激发态碳原子的核外电子排布式为![]() 而不是
而不是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com