
【题目】某小组同学通过下列实验探究了物质的溶解度大小、反应物浓度与沉淀转化方向之间的关系。
已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) |
|
|
|
|
(1)探究BaCO3和BaSO4之间的转化
实验操作:
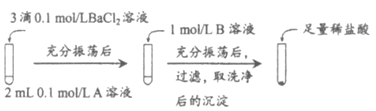
试剂A | 试剂B | 加入盐酸后的现象 | |
实验Ⅰ | Na2CO3 | Na2SO4 | 无明显现象 |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ中加入A溶液后生成沉淀的离子方程式为_____________。
②实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因________。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
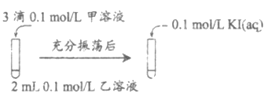
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| p>装置 | 步骤 | 电压表读数 |
| i. 如图连接装置并加入试剂,闭合K | a |
ii. 向B中滴入AgNO3(aq),至沉淀完全 | b | |
iii. 再向B中投入一定量NaCl(s) | c | |
iv. 重复i,再向B中加入与iii等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液是_____________(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
②实验Ⅳ中结合信息,解释电压b<a的原因:_____________。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_____________。
(3)综合实验Ⅰ~Ⅳ,下列说法正确的是_____________(填序号)。
a. 溶解度小的沉淀只能转化成溶解度更小的沉淀
b. 电化学是研究物质性质和转化的重要手段之一
c. 某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化
d. 溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
【答案】Ba2++CO32-=BaCO3↓ BaSO4在溶液中存在BaSO4(s)Ba2+(aq)+SO42-(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。 a 加入AgNO3后,生成AgI沉淀使B的溶液中c(I-)减小,I-还原性减弱,导致电压b<a 实验iv表明Cl-本身对该原电池电压无影响,则c>b说明加入Cl-使c(I-)增大,证明发生了:AgI+Cl-AgCl+I- bcd
【解析】
(1)①碳酸钠溶液中滴加氯化钡溶液生成碳酸钡沉淀,反应方程式为Ba2++CO32-=BaCO3↓;
②BaSO4在溶液中存在BaSO4(s)Ba2+(aq)+SO42-(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动。
(2)①实验Ⅲ中后最后加入的时0.1mol/L的KI溶液,应该是探究的是AgCl转化成AgI,加入的NaCl溶液应该过量,AgNO3溶液应该不足,根据图示可知,甲不足、乙过量,则甲溶液是AgNO3溶液,故选a;
②加入AgNO3后,生成AgI沉淀使B的溶液中c(I-)减小,I-还原性减弱,导致电压b<a;
③实验ⅳ表明Cl-本身对该原电池电压无影响,则c>b说明加入Cl-使c(I-)增大,证明发生了反应AgI+Cl-AgCl+I-,部分AgI转化为AgCl;
(3)a. 实验II和实验Ⅳ说明在一定条件下溶解度小的沉淀也可以转化成溶解度大的沉淀,故a错误;
b. 实验Ⅳ说明电化学是研究物质性质和转化的重要手段之一,故b正确;
c. 实验II和实验Ⅳ均表明某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化,故c正确;
d. 综合实验Ⅰ~Ⅳ可知:溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现,故d正确;
综上所述选bcd。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.苯乙烯和苯均能使溴水褪色,且原理相同
B.用饱和 Na2CO3 溶液可鉴别乙醇、乙酸、乙酸乙酯
C.用 Ni 作催化剂,1mol 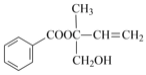 最多能与 5molH2 加成
最多能与 5molH2 加成
D.C3H6BrCl 的同分异构体数目为 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂离子电池容量的10倍,其工作原理示意图如图。

放电时,b电极为电源的__极,电极反应式为__。
(2)汽车尾气中CO、NO2在一定条件下可发生反应4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

①0~10min内该反应的平均反应速率v(CO)=__。
②恒温恒容条件下,不能说明该反应已经达到平衡状态的是__(填序号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应2A(g)+B(g)=3C(g)+4D(g),下列选项中表示该反应速率最快的是
A.v(A)=0.6 mol/(L·s)B.v(B)=0.2 mol/(L·s)
C.v(C)=0.8 mol/(L·s)D.v(D)=1.0 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)。在某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是

A.向混合溶液中加水,平衡逆向移动
B.反应I2(aq)+I-(aq)I3-(aq)的H<0
C.状态A与状态B相比,I2的消耗速率A<B
D.状态C与状态D相比,反应的平衡常数KC=KD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.2.8g N2 中含有的共用电子对数为 0.1NA
B.常温常压下,124克P4中所含P-P键数目为6 NA
C.32克硫单质在足量氧气中燃烧转移电子数为6 NA
D.在标准状况下,22.4 L H2O 中含有氧原子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
Ⅰ.铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如图:

(1)写出反应1中涉及的任意一个化学方程式____;
(2)滤液Ⅰ中加入CaO生成的沉淀是____,已知气体A在标准状况下的密度为1.96g/L,写出A过量时,反应2的离子方程式____;
Ⅱ.以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图:

(3)萤石(CaF2)的电子式____;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是____,写出由D制备冰晶石(Na3AlF6)的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,正确的是
A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.3 kJ·mol-1
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H =-2a kJ·mol-1
2NH3(g) △H =-2a kJ·mol-1
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l) =2H2(g)+O2(g) △H =-571.6 kJ·mol-1
D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量小于57.3KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为![]() ,含少量
,含少量![]() 、
、![]() 等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:

(1)下列措施无法加快浸取速率的是________(填字母)。
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增大硫酸浓度
(2)滤渣Ⅰ中的主要成分是![]() 、S、
、S、![]() ,请写出“浸取”反应中生成S的离子方程式:_________________________。
,请写出“浸取”反应中生成S的离子方程式:_________________________。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,原因可能是__________________________。
(4)“沉锰”(除![]() )过程中有关反应的离子方程式为________________________________。
)过程中有关反应的离子方程式为________________________________。
(5)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com