
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.2.8g N2 中含有的共用电子对数为 0.1NA
B.常温常压下,124克P4中所含P-P键数目为6 NA
C.32克硫单质在足量氧气中燃烧转移电子数为6 NA
D.在标准状况下,22.4 L H2O 中含有氧原子数为 NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
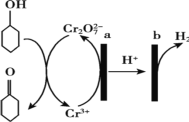
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):

已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,常将粗氧化锌粉碎成细颗粒,适当增加硫酸的浓度,目的是_________。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2 Zn(OH)2 ,该步骤需控制溶液pH的范围是____________,该步骤中先加入H2O2充分反应后再加入氨水,写出加入H2O2的离子方程式_____________。
(3)步骤C的反应离子方程式为____________。
(4)若步骤A中加入H2O2后,室温下将溶液的pH调为4,求Fe3+ 离子浓度为_________。(已知Ksp[Fe(OH)3]= 4.0×10-3 8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
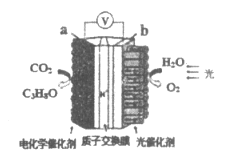
A.该装置将化学能转化为光能和电能
B.b电极上发生得e-的氧化反应
C.该装置工作时,H+从b极区向a极区迁移
D.a电极上反应:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过下列实验探究了物质的溶解度大小、反应物浓度与沉淀转化方向之间的关系。
已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) |
|
|
|
|
(1)探究BaCO3和BaSO4之间的转化
实验操作:
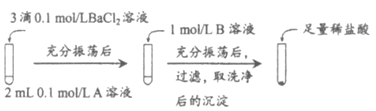
试剂A | 试剂B | 加入盐酸后的现象 | |
实验Ⅰ | Na2CO3 | Na2SO4 | 无明显现象 |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ中加入A溶液后生成沉淀的离子方程式为_____________。
②实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因________。
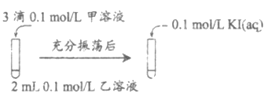
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| p>装置 | 步骤 | 电压表读数 |
| i. 如图连接装置并加入试剂,闭合K | a |
ii. 向B中滴入AgNO3(aq),至沉淀完全 | b | |
iii. 再向B中投入一定量NaCl(s) | c | |
iv. 重复i,再向B中加入与iii等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液是_____________(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
②实验Ⅳ中结合信息,解释电压b<a的原因:_____________。
③实验Ⅳ的现象能说明AgI转化为AgCl,理由是_____________。
(3)综合实验Ⅰ~Ⅳ,下列说法正确的是_____________(填序号)。
a. 溶解度小的沉淀只能转化成溶解度更小的沉淀
b. 电化学是研究物质性质和转化的重要手段之一
c. 某些沉淀转化反应可通过对反应物浓度的调节,实现逆向转化
d. 溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0L的密闭容器中加入0.60molX(g),发生反应X(g)![]() Y(s)+2Z(g),测得反应物X的浓度与反应时间的关系如表所示:
Y(s)+2Z(g),测得反应物X的浓度与反应时间的关系如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)0~3min内用Z表示的平均反应速度v(Z)=___。
(2)分析该反应中反应物的浓度与时间的关系,得出的结论是___。由此规律推出在6min时反应物X的浓度为___mol·L-1。
(3)该反应的逆反应速率随时间变化的曲线如图所示,t2时改变的条件可能是___、___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1molHCHO分子中含有σ键的数目为3mol
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为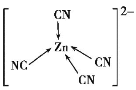
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法正确的是
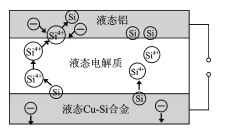
A.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B.液态Cu-Si合金作阳极,固体硅作阴极
C.电流强度的大小不会影响硅提纯速率
D.三层液熔盐的作用是增大电解反应接触面积,提高硅沉积效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com