
【题目】模拟“人工树叶”的电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
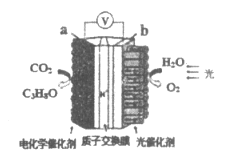
A.该装置将化学能转化为光能和电能
B.b电极上发生得e-的氧化反应
C.该装置工作时,H+从b极区向a极区迁移
D.a电极上反应:3CO2+18H+-18e-=C3H8O+5H2O
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应方向的描述中正确的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.知道了某过程有自发性之后,可预测反应过程发生的快慢
C.CaCO3(s)![]() CaO(s)+CO2(g) △H>0,该反应能否自发进行与温度无关
CaO(s)+CO2(g) △H>0,该反应能否自发进行与温度无关
D.冰融化为水的过程中:△H<0,△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法填写下列有机物的名称:![]() 的名称是__________________________。
的名称是__________________________。
(2)2,6-二甲基-4-乙基辛烷的结构简式是________,1mol该烃完全燃烧需消耗氧气________mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________。
②符合该条件的单烯烃的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
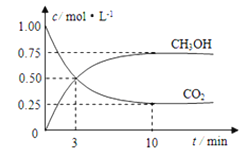
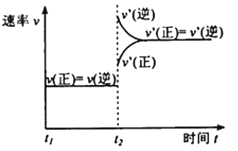
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________________。下图是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____________反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为______(保留两位小数),若提高温度到800℃进行,达平衡时,K值______(填“增大”、“减小”或“不变”)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______v(逆)(填“>”、“<”或“=”)。
(4)下列措施能使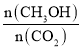 增大的是______。
增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应2A(g)+B(g)=3C(g)+4D(g),下列选项中表示该反应速率最快的是
A.v(A)=0.6 mol/(L·s)B.v(B)=0.2 mol/(L·s)
C.v(C)=0.8 mol/(L·s)D.v(D)=1.0 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)-空气电池的工作原理如图所示。下列说法不正确的是( )
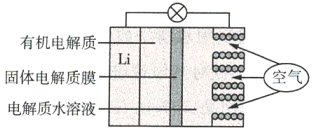
A.金属锂作负极,发生氧化反应
B.Li+通过有机电解质向水溶液处移动
C.正极的电极反应:O2+4e-=2O2-
D.电池总反应:4Li+O2+2H2O=4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.2.8g N2 中含有的共用电子对数为 0.1NA
B.常温常压下,124克P4中所含P-P键数目为6 NA
C.32克硫单质在足量氧气中燃烧转移电子数为6 NA
D.在标准状况下,22.4 L H2O 中含有氧原子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
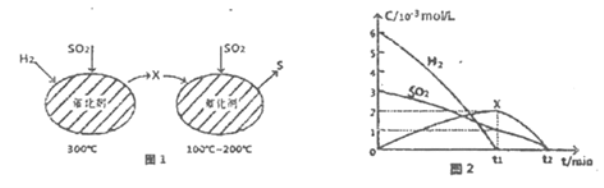
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳化合物种类繁多。回答下列问题:
(1)一定温度下,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为_________%。
CO2(g)+H2(g),已知此温度下,该反应的平衡常数K=16,则平衡时体系中H2的物质的量分数为_________%。
(2)在催化剂Ru催化下,CO2与H2反应可生成CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正______(填“增大”“减小”或“不变”,下同),v逆_______,平衡常数K________,转化率α________;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,则v正______(填“增大”“减小”或“不变”,下同),v逆_______,平衡常数K________,转化率α________;若在相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
c(CO2)/mol/L | c(H2)/mol/L | c(CH4)/mol/L | c(H2O)/mol/L | |
平衡I | a | b | c | d |
平衡II | m | n | x | y |
则a、b、c、d与m、n、x、y之间的关系式为_____________。
(3)已知相关物质的电离平衡常数如下表:

①0.1 mol·L-1的Na2CO3溶液的pH_______(填“大于”“小于”或“等于”)0.1 mol·L-1的Na2C2O4溶液的pH。
②若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中粒子浓度大小的顺序正确的是_________(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(CO32-)>c(C2O42-) d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com