
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
【答案】D
【解析】
A.容器体积缩小到原来一半(即加压)的瞬间,A的浓度为原来的2倍。新平衡时A的浓度为原来的2.1倍,即平衡左移。据平衡移动原理,有m+n <p+q,选项A正确;
B.设起始时A、B的物质的量分别为x、y,平衡时A、B的转化率分别为α、β。则(xα)∶(yβ)=m∶n。当α=β时,x∶y=m∶n,选项B正确;
C.m+n=p+q时,反应中气体分子总数不变。往含有a mol气体的平衡体系中再加入a mol B,不论是否达到新平衡,气体总物质的量都等于2a mol,选项C正确;
D.若缩小容器体积使新平衡压强是原来的2倍,则新平衡体积小于原来的![]() 。若通入与反应无关的气体使压强变成原来的2倍,则体积可以不变,选项D错误。
。若通入与反应无关的气体使压强变成原来的2倍,则体积可以不变,选项D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】中药丹参中存在丹参醇。一种人工合成丹参醇的部分路线如下:

已知:![]()
完成下列填空:
(1)A中官能团的名称:__________________。
(2)D→E的反应条件:___________________。
(3)A和B生成C的反应类型是:______反应。
(4)在铜做催化剂、加热条件下,1mol丹参醇能被_____molO2氧化。
(5)B的分子式是:C9H6O3。符合下列条件的B的同分异构体有__种,写出其中能发生银镜反应的同分异构体的结构简式_____。
①苯环上直接连有一个—OH
②—OH对位上还有一个侧链,该侧链含:—C![]() C—、—COO—。
C—、—COO—。
(6)利用已知条件,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲
的合成路线流程(无机试剂和乙醇任用,合成路线的表示方式为:甲![]() 乙
乙![]()
![]() 目标产物)。_____________
目标产物)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 分液漏斗可以分离甘油和水的混合物
B. 分子式为C5H10Cl2,结构中含有一个-CH3的同分异构体有7种
C. 由甲苯制取三硝基甲苯的反应与乙酸和苯甲醇反应的类型不同
D. 有机物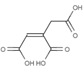 能发生氧化、还原、加成、加聚和取代反应
能发生氧化、还原、加成、加聚和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出。现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mLA溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体。
②取25mLB溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体。
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式______;
(2)为使上述①②反应完全,还需加入______;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③B.①②③④C.①②③D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
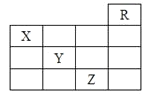
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐;
②Y、Z的气态氢化物水溶液的酸性Y<Z;
③Z的单质常温下是液体,可与铁粉反应;
④Z的原子序数比Y大19;
⑤Z所在的周期中含有32种元素
A.①②③④B.①②③④⑤C.只有③D.只有①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。
(2)团簇 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
(3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。
(4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
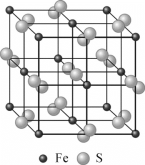
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3 和NaClO2是制取ClO2的常见原料。完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4+2NaClO3+H2SO4→Na2SO4+2CO2↑+2ClO2↑+2H2O
上述反应物中属于第三周期元素的原子半径大小顺序是___;其中原子半径最大元素的原子,其核外电子排布式为___,其核外有___种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有___(填“氧化”、“还原”)性的物质。
(5)工业上制取NaClO3通过电解法进行,电解时,不同反应环境下的总反应分别为:
4NaCl +18H2O→4NaClO3+3O2↑+18H2↑(中性环境)
NaCl +3H2O→NaClO3 +3H2↑(微酸性环境)
①电解时,氢气在___极产生。
②更有利于工业生产NaClO3的反应环境是___,理由__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com